科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-24
来源:BioArt
责编 | 兮
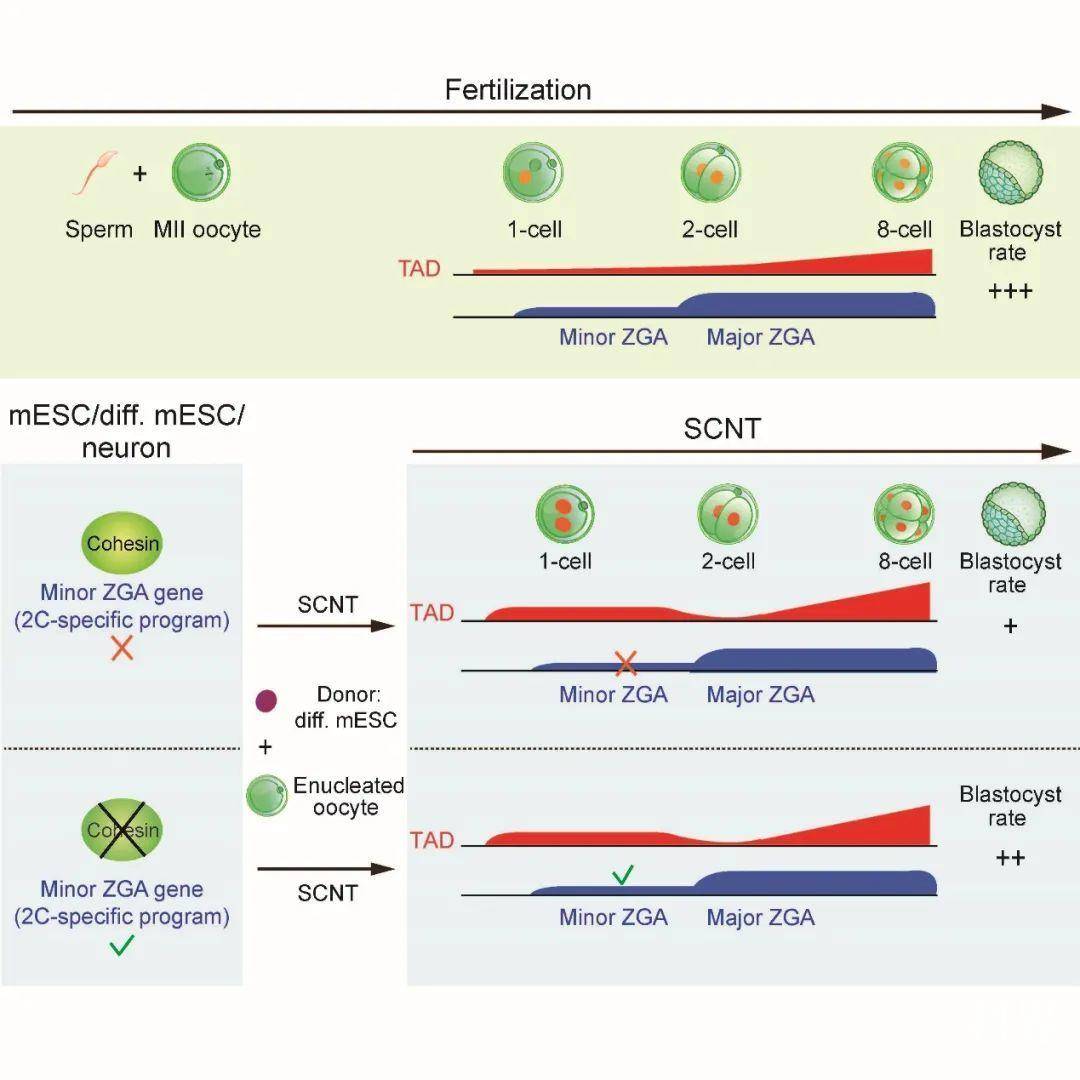
体细胞核移植技术(Somatic cell nuclear transfer,SCNT)可以在体外高效的把终末分化的体细胞的细胞核重编程为全能性状态。然而核移植胚胎的发育能力明显低于正常胚胎的发育能力,提示这其中可能有表观遗传记忆重编程的缺陷。核移植胚胎发育过程伴随着剧烈的染色体高级结构的重编程。由于细胞数量和实验手段的限制,此过程的染色体三维结构的高分辨率的动态变化之前一直研究甚少。
另外,清华大学生命科学学院颉伟实验室与其他实验室研究发现,早期胚胎中染色体高级结构如拓扑结构域(Topologically associating domain, TAD)等发生异常松散,并且该现象在进化中高度保守(果蝇、鱼、小鼠和人类),然而其功能和机制一直是未解之谜。
2020年6月23日,颉伟研究组与华中农业大学动科动医学院苗义良研究组合作在Molecular Cell杂志上发表了题为“Analysis of genome architecture during SCNT reveals a role of cohesin in impeding minor ZGA”(关于体细胞核移植过程中染色体三维结构的分析揭示了黏连蛋白在抑制初级合子基因激活中的作用)的研究论文,报道了体细胞核移植过程中染色体高级结构经历多步重编程过程,并且首次发现黏连蛋白(cohesin)可以抑制初级合子基因激活(minor ZGA)相关基因的表达。

在这一工作中,研究人员利用sisHi-C技术,系统检测了在SCNT各个时期以及其后胚胎发育过程中染色体结构,并和正常受精的胚胎发育进行了对比。研究者发现,SCNT胚胎发育体系中,这种进化保守的染色体松散也会发生,提示不管染色质的来源如何,卵细胞质都可以将其转化为一个更加松散的状态。具体来说,在SCNT过程中,体细胞的细胞核在移植后会首先进入一个类有丝分裂的状态。与正常受精早期胚胎中TAD在1细胞大幅度松散不同,SCNT胚胎在1细胞阶段具有清晰的TAD结构,但在2细胞阶段仍然出现了松散的TAD结构,之后TAD又逐渐增强。从另一个维度,染色质区室结构(compartment)在SCNT的1细胞时期非常弱,然而之后会逐渐增强。在SCNT胚胎发育的8细胞时期之前,SCNT染色体三维结构已经与受精胚胎基本类似。
同时,研究人员意外发现,在多能性干细胞和终端分化的细胞中敲除对拓扑结构域的建立具有核心功能的黏连蛋白(cohesin),不仅能够消除TAD,而且能够激活初级合子基因激活基因(minor ZGA),包括Zscan4等重要基因。这些基因在正常胚胎发育过程中通常先于绝大部分基因被激活,并对早期胚胎发育有重要功能,参与基因组稳定性,端粒延长等功能。然而在SCNT胚胎这些基因不能正常表达。研究人员发现,在供体细胞中提前去除黏连蛋白,可以激活minor ZGA相关基因并显著提高SCNT的囊胚发育成功率。
综上所述,这一工作揭示了染色质高级结构在体细胞核移植中的重编程过程,并且发现了黏连蛋白具有形成TAD和抑制minor ZGA基因的双重功能,为研究早期胚胎发育过程中独特的松散染色质的功能和机制提供了重要线索。
清华大学生命科学学院颉伟教授和华中农业大学动科动医学院苗义良教授为本文共同通讯作者。清华大学生命科学学院博士生张珂,华中农业大学动科动医学院吴丹雅,清华大学生命科学学院CLS项目博士后郑辉,以及清华大学生命科学学院博士生王瑶为本文共同第一作者。
清华大学生命学院颉伟实验室招聘实验室科研秘书
实验室研究方向:
研究兴趣包括表观遗传学,基因组学和发育生物学。同时利用分子生物学、发育生物学和计算生物学的方法,采用干湿实验结合的方式,研究干细胞分化和个体发育以及人类疾病中的表观遗传调控机制。本实验室致力于:(1)动物胚胎早期发育过程中的表观遗传调控;(2)干细胞分化过程中的表观遗传调控;(3)调控序列如启动子、增强子、绝缘子以及三维基因组在发育和细胞命运决定过程中的功能;(4)表观遗传相关人类疾病的调控机理。
实验室主页:http://www.xielab.org.cn/
代表性工作:
Xiang et al. (2020) Epigenomic analysis of gastrulation identifies a unique chromatinstate for primed pluripotency. Nature Genetics 52 (95-105).
Xia et al. (2019) Resetting histone modifications during human parental-to-zygotictransition. Science 365 (353-360).
Wu et al. (2018) Chromatin analysis in human early development reveals epigenetictransition during ZGA. Nature 557 (256–260).
Du et al. (2017) Allelic reprogramming of 3Dchromatin architecture during early mammalian development. Nature 547 (232-235).
Zhang et al. (2016). Allelic reprogramming of the histone modificationH3K4me3 in early mammalian development. Nature 537 (553-557).
Wu et al. (2016). Thelandscape of accessible chromatin in mammalian preimplantation embryos. Nature534 (652-657).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652488871&idx=4&sn=f6b30cb6803bd9c92116e8b02b332055&chksm=84e25713b395de051345e0f48a97937262c420568d1a5ebda1fb4d32624f77483bb42fc6fc0d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
新工具有助揭示胚胎发育等细胞过程

晋中召开全市科协系统深化改革工作推进会

Science :胚胎发育原肠胚形成过程中流体机械力的存在

研究获得青鳉胚胎发育过程中的转录及调控动态图谱
胚胎发育过程中与癌细胞Warburg效应之间的异曲同工之处

温万一到省农函大调研“三基建设”工作
胚胎发育有“慢动作”

习近平:更好完成新形势下宣传思想工作使命任务
胚胎发育
新系统可模拟人类胚胎早期发育最关键过程