科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-05
来源:BioArt
撰文 | 十一月
组织形态发生过程是由细胞变形驱动的,主要机械力的来源是收缩肌动球蛋白。但是这些力是如何跨越整个组织对胚胎进行塑形的不甚清楚。
近日,法国索邦大学Francis Corson研究组与法国巴斯德所Jerome Gros研究组联合在Science发表题为A tensile ring drives tissue flows to shape thegastrulating amniote embryo 的文章,对鸟类胚胎原肠胚形成过程中形变驱动来源进行了解析,发现层层推进的组织形变来源于胚胎和胚外区域边缘大范围的肌动蛋白环逐步收缩所驱动的。

在脊椎动物原肠胚形成过程中,中胚层和内胚层通过原条(Primitive streak, PS)形成向内推动内化。在鸟类中,原条最初是在胚体(Embryo proper, EP)与胚外组织(Extra-embryonic tissue, EE)的边缘由半月形区域发育形成的,原条向中线汇合并沿中线延伸【1,2】(图1)。但是在此过程中,伴随着类似于螺旋形状的组织流以及与之相关的原条是如何形成的还不得而知。为了对原肠胚形成过程中组织结构的运动过程进行分析,作者们使用了具有表达跨膜GFP的转基因鸟类卵进行体外培养以及长时间的成像。结果显示,EP区域在整个检测过程中保持着基本恒定的区域大小,而EE区域持续扩增(图1)。原肠胚移动的驱动力主要是三个方面的力的总和:EE组织扩增而引发的向外的发散的移动;EP区域两个涡旋流动;以及在后期阶段沿着原条区域向内的移动。
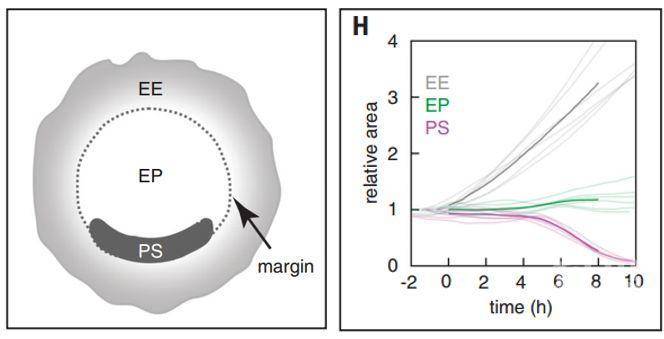
图1 鸟类胚胎发育中结构示意图以及胚胎不同结构区域的相对变化
当在外胚层出现组织流动的时候,会沿着胚胎边缘产生一种伸到前半部分的切向力。力的模式是环绕着EP的一个张力环随着组织范围的延伸从后端向前端逐渐衰减。由此,沿着EP侧的组织向后端移动,后端拉力更高;而后端的组织由于EP与EE的交界边缘的弯曲而被挤向前,活跃的张力在很大程度上决定了胚胎的形成,因为EE的扩增需要张力的推动(图2)。
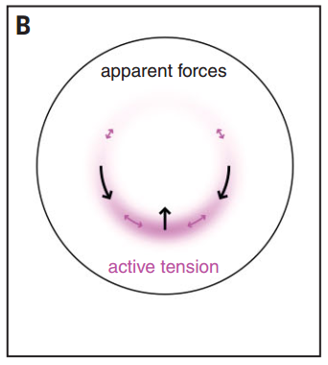
图2 张力环驱动组织流动驱动原肠胚移动
作者们建立的模型表明原肠胚形成过程伴随着EE与EP之间边缘张力环的出现以及上皮外胚层类似于流体的响应。为了进一步证明这一观点,作者们首先使用环形激光切割【3】的方式来检测张力环的存在。环形激光切割的位置如果是在EP或者是EP与EE交界的地方,应力各向异性(Strain anisotropy)会较高,而环形切割的位置如果是在胚体内部,则切口应变明显较低。这说明EP和EE交界的边缘确实有张力环的存在。
另一方面,作者们想要知道卵中存在组织流动性的细胞基础是什么。因为细胞重排会对上皮组织应力的松弛有一定的影响【4】,而早期卵中的细胞重排大多数是由细胞分裂引起的【5】。作者们希望检测组织中类似于流体的现象是否是由于细胞分裂引起的。在抑制了细胞分裂同时也抑制细胞坏死的情况下,组织变得非常稳定没有了明显的流动性。在药物处理之后的6-8小时时间,卵发育明显变慢而且原条不能正常形成。组织扩增仍在进行,但旋转的移动完全消失,这与流动性抑制的表型是一致的。
Francis Corson研究组与Jerome Gros研究组所建立的模型与实验数据证明了在胚胎发育原肠胚形成过程中流体机械力【6-8】的存在。相较于前人的研究中所提到组织流动是由于原条形成过程中而被动产生的产物【1】而言,作者们的工作发现沿着胚体和胚外组织边缘的张力环会驱动原条的形成,通过将胚胎作为一个整体进行塑造。该工作发现胚胎边缘作为早期胚胎发育过程的分子组织处同样也具有特殊的机械状态和行为特点,机械力与相关分子的相互协作建立了脊椎动物早期的身体图示。
原文链接:
https://science.sciencemag.org/content/367/6476/453
参考文献
1. Voiculescu, O., Bertocchini, F.,Wolpert, L., Keller, R. E. & Stern, C. D. The amniote primitive streak isdefined by epithelial cell intercalation before gastrulation. Nature 449, 1049-1052, doi:10.1038/nature06211 (2007).
2. Rozbicki,E. et al. Myosin-II-mediated cellshape changes and cell intercalation contribute to primitive streak formation. Nat Cell Biol 17, 397-408, doi:10.1038/ncb3138 (2015).
3. Chapman,S. C., Collignon, J., Schoenwolf, G. C. & Lumsden, A. Improved method forchick whole-embryo culture using a filter paper carrier. Dev Dyn 220, 284-289,doi:10.1002/1097-0177(20010301)220:3<284::AID-DVDY1102>3.0.CO;2-5 (2001).
4. Guillot,C. & Lecuit, T. Mechanics of epithelial tissue homeostasis andmorphogenesis. Science 340, 1185-1189,doi:10.1126/science.1235249 (2013).
5. Firmino,J., Rocancourt, D., Saadaoui, M., Moreau, C. & Gros, J. Cell DivisionDrives Epithelial Cell Rearrangements during Gastrulation in Chick. Dev Cell 36, 249-261, doi:10.1016/j.devcel.2016.01.007 (2016).
6. Streichan,S. J., Lefebvre, M. F., Noll, N., Wieschaus, E. F. & Shraiman, B. I. Globalmorphogenetic flow is accurately predicted by the spatial distribution ofmyosin motors. eLife 7, doi:10.7554/eLife.27454 (2018).
7. He,B., Doubrovinski, K., Polyakov, O. & Wieschaus, E. Apical constrictiondrives tissue-scale hydrodynamic flow to mediate cell elongation. Nature 508, 392-396, doi:10.1038/nature13070 (2014).
8. Smutny,M. et al. Friction forces positionthe neural anlage. Nat Cell Biol 19, 306-317, doi:10.1038/ncb3492(2017).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652482974&idx=5&sn=7c99686d461736053c430479fee5ccf9&chksm=84e23e2ab395b73cfeb3a3cfce241ec51c94329aaadc4004eddfa880490636a8027b922c97dc#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
后张力

类折纸结构可显著减轻航天器着陆冲击

纤维制成的衣服为什么不会散架?科学家终于解谜

神奇的表面张力
张力推平台
前张力
张力膜结构
位错线张力

单细胞转录组揭示脊索动物原肠胚动态形成过程
无张力轧制