科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-17
来源:BioArt
心血管疾病是影响人类健康,威胁人类死亡的头号杀手。在全世界范围内,平均每10秒钟就有一人死于心血管疾病,而针对心血管疾病特效药的缺乏使得心血管疾病成为一个日益增长的公共健康问题。心力衰竭(heart failure)是一类主要的心血管疾病,而心脏纤维化(cardiac fibrosis)是晚期心脏病的一个重要表征和引发心力衰竭的一个主要因素。心脏成纤维细胞(cardiac fibroblast)是心脏纤维化的“始作俑者”。心脏成纤维细胞能合成和分泌胞外基质蛋白,对维持心脏正常形态起关键作用,然而,在心脏病的发生过程中,成纤维细胞分泌过量的细胞外基质蛋白会影响心脏正常的收缩和舒张功能,从而引发心室泵血和充盈功能低下,最终导致心力衰竭。因此,降低心脏成纤维细胞分泌的细胞外基质蛋白的表达成为治疗心脏病和预防心力衰竭的一个必要步骤。此前,大量的研究集中在成纤维细胞的增殖激活和胞外基质蛋白基因表达的转录调控。虽然人们最近已经意识到,在心脏纤维化的过程中,基质蛋白的翻译调控可能起着同样举足轻重的作用【1】,然而对于心脏纤维化过程中的翻译调控机理仍知之甚少。
胞外基质是一类富含脯氨酸(proline-rich)的蛋白质,其蛋白质的一级序列中含有大量脯氨酸尤其是脯氨酸-脯氨酸的双氨基酸肽的序列。大多数已知导致心脏纤维化的蛋白(pro-fibrotic protein),诸如常见的胶原蛋白【图1】和最近通过心脏单细胞深度测序发现的小鼠心脏纤维化指标蛋白CKAP4【2】和IL-11【3】,都被发现属于这一类蛋白。不同于其他19种合成蛋白质所必须的氨基酸,脯氨酸侧链与其氨基形成一个独特的环状结构【图1】,使得脯氨酸更难与其他氨基酸生成肽键联接和形成多肽链结构,从而使得信使RNA(mRNA)上脯氨酸特别是双脯氨酸遗传密码子基序成为蛋白质合成过程中的限速步骤。因此,富含脯氨酸的蛋白质的翻译合成高度依赖于细胞内脯氨酰-tRNA的催化合成效率,尤其是在需要大量合成这类蛋白质的病理过程中。在哺乳动物细胞胞质中,唯一催化合成脯氨酰-tRNA的酶是谷氨酰-脯氨酰-tRNA合成酶(glutamyl-prolyl-tRNAsynthetase,EPRS)。EPRS催化合成脯氨酰-tRNA是翻译合成含有脯氨酸多肽链的必要酶。然而,EPRS在心脏成纤维化的过程中,对于细胞外基质蛋白的翻译调节作用以及其作为抑制心脏纤维化的靶标分子的潜在功效仍然不是很明了。
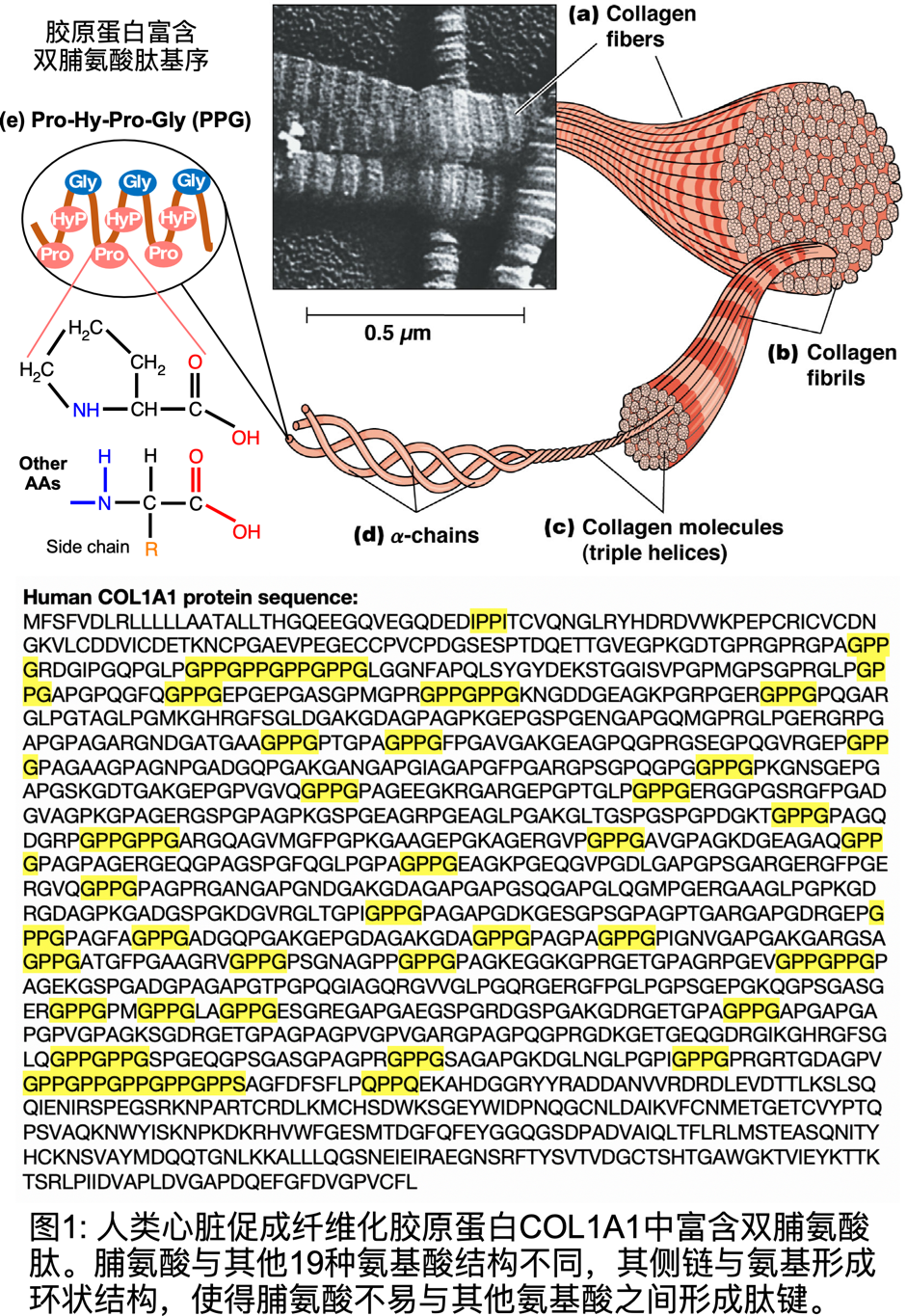
近日,美国罗切斯特大学Aab心血管研究所姚鹏博士团队在Circulation Research上在线发表题为Glutamyl-Prolyl-tRNA Synthetase Regulates Proline-Rich Pro-fibrotic Protein Synthesis During Cardiac Fibrosis的研究【4】,首次揭示EPRS中的脯氨酰-tRNA合成酶在心脏成纤维化过程中对富含脯氨酸特别是双脯氨酸肽(XPPY,X和Y为任意氨基酸,PP是Pro-Pro)的细胞外基质蛋白的翻译调节作用,并在动物水平上指出适量减少翻译因子EPRS的表达能有效降低心脏成纤维化,改善心脏功能。

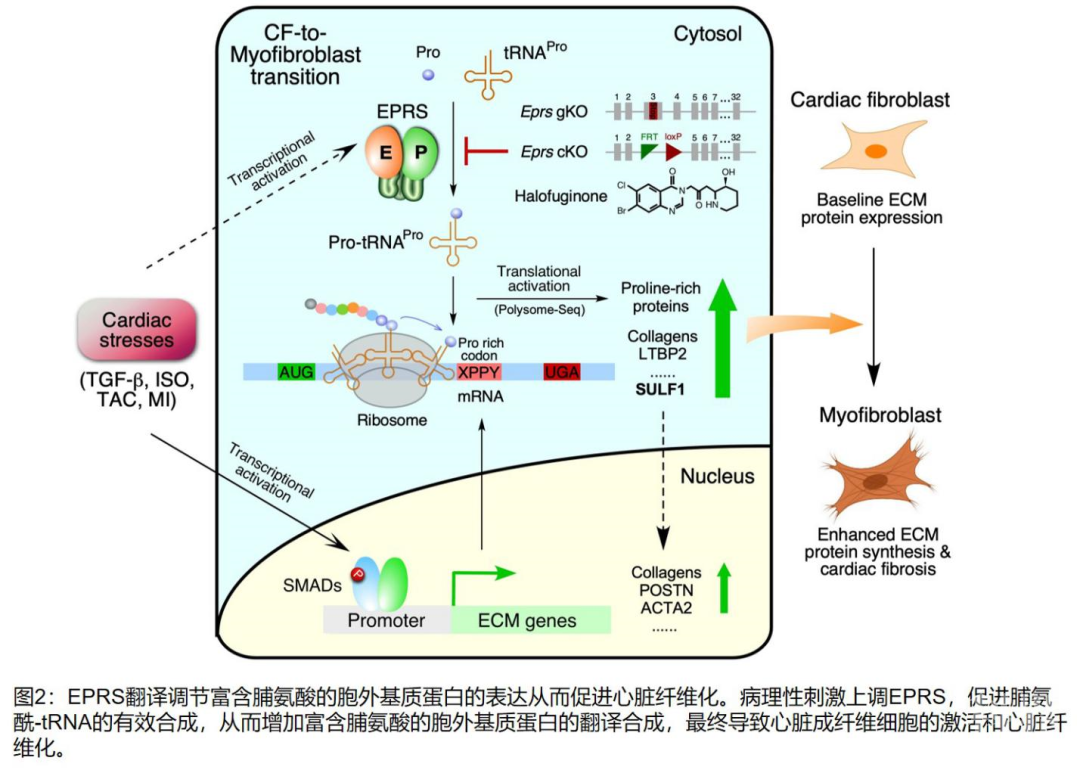
通过对已发表高通量数据以及基因突变数据库的再分析,研究者发现EPRS在人和小鼠病理性的心脏肥大和伴随的纤维化过程中高表达,而在运动后生理性肌肉肥大过程中正常表达。已知富含脯氨酸的细胞外基质蛋白的大量合成仅发生在病理性但不发生在生理性肌肉肥大过程中。而且,在转化生长因子(TGF-β)诱导的人源心脏成纤维细胞中,EPRS相较于其他胞质氨基酰-tRNA合成酶和蛋白翻译因子发生显著上调。鉴于此,研究者认为EPRS的高表达对于维持病理性心肌肥大和纤维化过程中富含脯氨酸蛋白质的大量合成起关键作用。利用CRISPR-Cas9技术全局性敲除小鼠体内一条染色体上的EPRS基因能够有效降低异丙肾上腺素(isoproterenol)、主动脉缩窄(transverse aortic constriction, TAC)以及心肌梗塞(myocardial infarction,MI)导致的小鼠心脏病理性胶原蛋白的表达和心脏成纤维化。此外,在成体活化的成纤维细胞中特异性敲除其中一条染色体上的EPRS同样能够减少主动脉缩窄诱导的促心脏纤维化蛋白的表达分泌,有效改善心脏功能。相反,在体外分离的小鼠心脏成纤维细胞中过表达EPRS能够刺激转化生长因子(TGF-β)诱导的富含双脯氨酸肽的胶原蛋白的翻译合成。在机理上,研究者认为EPRS的高表达能够催化形成高水平的脯氨酰-tRNA,直接增强富含脯氨酸的基质蛋白的翻译,从而促进病理条件下的心脏纤维化。
已有研究表明,在人类基因组中,一些自发产生的EPRS基因的随机突变会降低EPRS中的脯氨酰-tRNA合成酶的酶学活性,这些突变的携带者患有脱髓鞘性脑白质退化症,但所有患者并未观测到心脏功能的异常。这项来自人类遗传学研究的发现提示适当地抑制EPRS的酶学活性不会对心脏的正常生理功能产生负面影响,反而可能通过抑制双脯氨酸肽富集的促纤维化蛋白的合成达到降低心脏纤维化的效果。上世纪六十年代越战期间,美国军方曾通过化合物合成筛选,发现用于治疗疟疾和心率不齐的中药常山里提取的主要的药效成分febrifugine 的修饰增强版的衍生物halofuginone(Halo)具有较低的毒性。Halo后被美国食品药品监督管理局批准为食用类动物的抗寄生虫药物和治疗皮肤硬化症的孤儿药。2012年,哈佛大学医学院的Dr. Malcolm Whitman 实验室通过筛选发现Halo的药物靶点是EPRS中的脯氨酰-tRNA合成酶,进而揭示了Halo通过抑制寄生虫体内蛋白质合成而具有抗疟疾的功效【5】。2013年,Scripps 研究所的Dr. Paul Schemmel实验室通过晶体学手段获得Halo和脯氨酰-tRNA合成酶及ATP底物的共晶结构【6】。结果显示Halo结合在脯氨酰-tRNA合成酶的酶学活性中心阻断其对两种底物脯氨酸和tRNAPro的结合,从而抑制tRNAPro对脯氨酸的接载。低浓度的Halo曾在Akashi公司主持的二期临床试验中被用于治疗杜兴式肌肉萎缩症(Duchenne Muscular Dystrophy)。结果显示肌肉病变过程中伴随的纤维化被抑制,但肌肉细胞的再生并未有效激活。Akashi公司将开发权转让给Processa Pharmaceuticals公司用于进一步开发治疗肺纤维化的药物。与此同时,葛兰素史克(GSK)公司利用低浓度的Halo有效地在血管紧张素渗透泵皮下植入,主动脉缩窄,和缺血-再灌注三种小鼠心衰的疾病模型中实现了对心脏功能的保护【7】。研究人员未发表的结果也显示,低浓度的Halo在异丙肾上腺素皮下注射的心衰模型中也有类似的心脏保护效果。这些研究发现支持了使用脯氨酰-tRNA合成酶抑制剂治疗心脏纤维化的潜在功效。到目前为止,针对16种氨基酰-tRNA合成酶的几十个抑制剂被用于开发新型抗生素,其中仅有针对脯氨酰-tRNA合成酶的三种抑制剂被明确用于潜在治疗多个器官(包括心脏,肺,肝,肾和皮肤等)的纤维化疾病。
为进一步探索脯氨酰-tRNA合成酶抑制在降低心脏纤维化过程中发生的转录组和翻译组水平的基因表达变化,进而深入剖析用Halo进行潜在心脏纤维化治疗过程中的药物靶点和伴生的副作用,研究者利用蔗糖密度梯度离心将Halo处理过(相较于溶剂对照处理组)的小鼠成纤维细胞胞浆分离出不同数量的多核糖体组分(polysome profiling),然后对不同数量的多核糖体组分进行高通量测序(RNA-seq)来研究抑制EPRS之后在翻译水平上被沉默表达的靶标蛋白。作者发现尽管EPRS理论上对细胞内所有含有脯氨酸的蛋白质的翻译都是必须的,然而抑制部分EPRS活性只能降低少部分蛋白质的翻译,这其中包含了研究者之前已知的很多富含双脯氨酸肽的蛋白质,包括胶原蛋白(COL1A1,COL3A1等)。而且,这类被翻译抑制的基因mRNA的稳态表达也同步下调,说明减弱的核糖体保护可能会加快mRNA的降解。有趣的是,非脯氨酸富集的大量管家基因(housekeeping genes)的翻译非但未发生下降,反而出现不同程度的上升。这些管家基因包括氨基酰-tRNA合成酶和核糖体蛋白等蛋白质翻译合成机器的组成性蛋白的编码基因,因此这个现象很好的诠释了氨基酸饥饿反应所引起的代偿效应。与此同时,研究者也发现了一些全新的富含脯氨酸-脯氨酸双氨基酸序列的蛋白受到EPRS的翻译调节,例如硫酸酯酶SULF1。而SULF1在人和小鼠活化的心脏成纤维细胞中高表达,可以用来作为心脏成纤维细胞活化的一个新的分子标志。同时,利用RNA干扰技术(RNAi)抑制SULF1的表达能够有效抑制分离的小鼠心脏原代成纤维细胞的活化。相反,利用慢病毒过表达SULF1则能够促进心脏成纤维细胞的活化。此外,SULF1的过表达在一定程度上也能够拯救Halo介导的EPRS活性抑制所导致的心脏成纤维细胞中的胶原蛋白合成的抑制。这说明EPRS能在两方面调节心脏成纤维细胞中富含脯氨酸的胶原蛋白的表达:1)直接调节其蛋白质的翻译水平;2)通过调节SULF1来间接调节胶原蛋白的表达(图2)。
据悉,在该稿件尚在审阅修改期间,英国的心脏科医生斯多尔特-库克博士(Dr. StuartCook)在读到研究者们上传到预印版网站BioRxiv的文章后,主动联系该团队,询问他们新发现的并很感兴趣的一个促进多器官纤维化的蛋白因子白介素-11(IL-11)是否在研究者的翻译组测序(polysome-Seq)中发现其在Halo的抑制作用下发生翻译下调。他们之前发表的工作显示IL-11是一个决定促纤维化蛋白质翻译的重要细胞因子【3】。在重新回顾研究者的翻译组测序数据后,的确发现小鼠的IL-11 mRNA翻译效率发生一定程度的下降。然而,当比较小鼠和人的IL-11蛋白质的序列,惊奇地发现人的IL-11相较于小鼠同源蛋白含有更为富集的双脯氨酸基序。这个现象暗示人源的IL-11可能对Halo的抑制作用更为敏感。也许这能在某一方面解释一些人体的临床药物治疗试验的效果和小鼠模型中前临床试验的结果不完全一致的原因。其中一种可能的解释便是作为药物靶点的蛋白质序列在啮齿类动物到灵长类动物的进化过程中发生了改变(如遗传密码子的重排),从而对药物的灵敏度也相应地发生了变化。植物类药材中所含有的抑制氨基酰-tRNA合成酶的化学成分可能对动物体内特定遗传密码子组成的mRNA的翻译产生负向调节,从而影响到动物体的核酸代谢和蛋白合成,进而产生特定的治疗性效果,诸如杀灭体内寄生虫或抑制器官纤维化。而中药材的汤剂配方和高度稀释的特征也解释了其低毒副作用的优点,因而在使用纯的化合物进行治疗时,保守的剂量和合适的治疗窗口将是保证药物疗效并降低副作用的关键所在。
此项工作首次揭示了心脏纤维化过程中促心脏纤维化基因的一种新的翻译调节机理,证实EPRS通过调节富含双脯氨酸肽的胞外基质蛋白的翻译来调节促纤维化蛋白的合成和分泌,从而影响心脏纤维化的进程。研究提示,过量的EPRS表达是心脏纤维化的一个重要组成部分,而通过限制或降低EPRS的过度表达或者活化能够有效抑制心脏纤维化的过程,改善心脏功能。同时,也发现了EPRS选择性翻译调节的新靶标,为心血管疾病的预防和治疗提供了全新的靶点。目前,大量研究表明蛋白质合成的轻微下调,诸如利用雷帕霉素介导的mTORC1信号通路的抑制,可以有效地延长多个物种的寿命(包括酵母,线虫,果蝇和小鼠)。同样,针对氨基酰-tRNA合成酶的轻微抑制也可以延长线虫在低氧压力下的寿命【8】。对于人体而言,不难理解通过对脯氨酰-tRNA合成酶抑制介导的纤维化的降低,可能会有效改善心脏在缺血和缺氧性压力下的生理功能乃至多器官功能,从而实现寿命的延长。因此,通过调节致病性蛋白质的合成可以开发新的心脏病治疗方案,通过对翻译调控通路的抑制筛选也可以发现全新的疾病诊断指标和治疗靶点。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652491956&idx=6&sn=527895483bbdb60c0588ee2528ec5de3&chksm=84e24300b395ca1676c6c053eebac9e3c39bedd7a4a1fc74870d72b03d017d71e2b5db8fb4c1#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Nat Commun:发现血管生成性成纤维细胞可促进血管修复
王志珍会长致2015年国际蛋白质学会“青年科学家奖”获奖者颜宁的贺信

转录因子成新靶点!转录开关调控心脏成纤维细胞活化
脯氨酸检查
Nature | 为生物大分子的特异性标记提供理论基础——含炔烃氨基酸的生物合成
N-苄氧羰基-L-羟脯氨酸
羟脯氨酸检查
甘氨酰脯氨酸二肽氨基肽酶

比生物界“AlphaGo”更厉害的模型来了?
L-脯氨酸苄酯盐酸盐