科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-12
来源:BioArt
责编丨兮
代谢重编程为细胞的快速增殖与生长提供原料,肿瘤细胞的标志之一。与正常细胞的氧化磷酸化不同,肿瘤细胞即使在氧气充足的情况下,也会选择大量摄取葡萄糖通过有氧糖酵解(aerobic glycolysis)生成乳酸与ATP,称为瓦伯格效应(Warburg effect)。这些代谢通路的转变,通常伴随着细胞的恶性转化,而背后的机制至今尚未完全阐明。复旦大学余巍课题组长期从事衰老相关基因SIRT家族调控肿瘤等衰老疾病的研究。此前,该课题组就揭示了SIRT1响应氧化应激调控酪氨酸tRNA合成酶的工作(PNAS 2017),线粒体中SIRT3调控一碳单位代谢酶参与结直肠肿瘤发生的分子机制(Nature Communications 2018;Cell Death & Disease 2020)。
2020年7月11日,复旦大学余巍课题组在Cell Reports在线发表文章Acetylation stabilizes Phosphoglycerate dehydrogenase by disrupting the interaction of E3 ligase RNF5 to promote breast tumorigenesis,发现SIRT2可以调控丝氨酸合成通路中的限速酶PHGDH阻止其E3泛素连接酶RNF5泛素化修饰并降解。

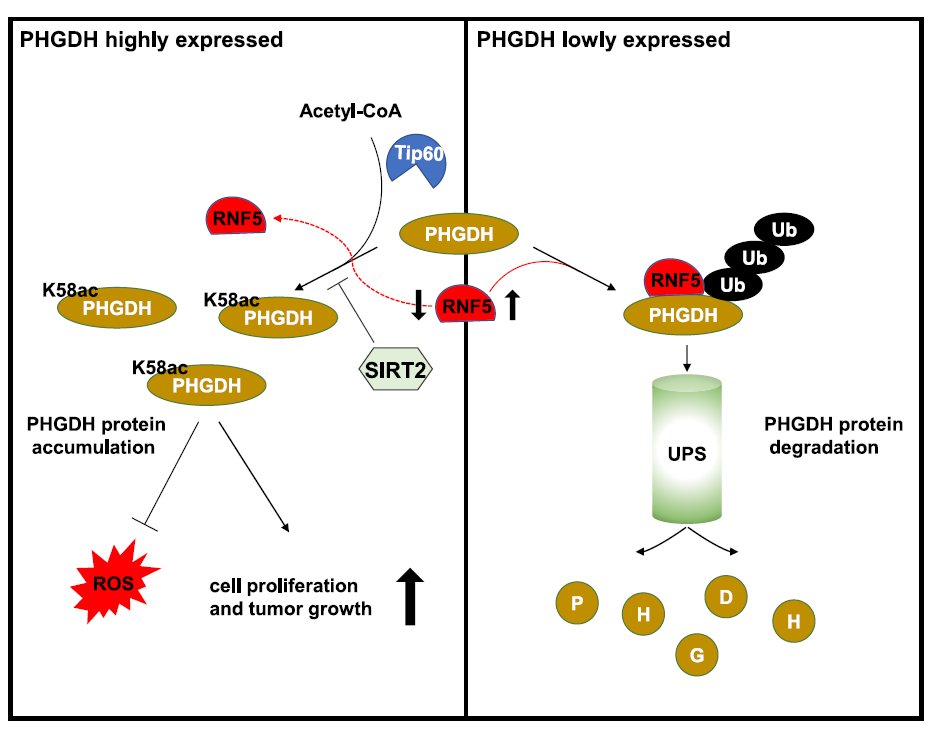 (图示:SIRT2和Tip60调节PHGDH的可逆乙酰化修饰对葡萄糖进行响应,PHGDH在K58的乙酰化破坏了泛素连接酶RNF5与PHGDH的结合从而阻止了PHGDH的降解)
(图示:SIRT2和Tip60调节PHGDH的可逆乙酰化修饰对葡萄糖进行响应,PHGDH在K58的乙酰化破坏了泛素连接酶RNF5与PHGDH的结合从而阻止了PHGDH的降解)PHGDH是丝氨酸合成途径中的限速酶,它的高表达与多种肿瘤有关。在约40%的黑色素瘤和6%的乳腺癌中存在PHGDH基因的拷贝数增加。然而,最近有研究表明,在没有拷贝数增加的情况下,PHGDH仍然高表达并促进了乳腺癌的发生。这表明在细胞中,除了基因拷贝数增加外,还存在某种机制,可以调节PHGDH的表达。余巍课题组研究发现,E3泛素连接酶RNF5可以通过泛素化促进PHGDH蛋白的降解,并降低细胞内的丝氨酸/甘氨酸水平。丝氨酸/甘氨酸的缺乏抑制了肿瘤细胞的抗氧化和增殖能力。SIRT2和Tip60调节PHGDH的可逆乙酰化修饰对葡萄糖进行响应,PHGDH的乙酰化修饰作为调节信号,抑制PHGDH-RNF5的相互作用,从而促进了肿瘤细胞中PHGDH蛋白的累积,为肿瘤细胞中PHGDH的高表达提供了新的解释。此研究揭示了SIRT2-PHGDH调控轴在肿瘤形成中的作用,为开发靶向SIRT2-PHGDH调控轴治疗肿瘤的小分子药物提供理论基础。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652495337&idx=6&sn=0bf3ac27ec3f2492b6f7bf69f041514a&chksm=84e24e5db395c74bf5b136a2dd5ca116bd33fd7b224d4d2b89ba0737ab7a3d466c0dcc973a2d#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

CGCS2021 | 向阳教授领衔,共谈妊娠滋养细胞肿瘤诊治规范——妊娠滋养细胞肿瘤专场

人体细胞内存在“铁路”系统,能自动优化结构

肿瘤干细胞研究取得进展
肿瘤干细胞最新研究进展
Nat Commun:中性粒细胞或会促进肿瘤细胞死亡
《细胞》子刊:找到免疫细胞突袭肿瘤的“快速通道”
失去细胞核的细胞在3D环境中举步维艰
从健康细胞到癌细胞,或许只需要几个突变
肿瘤干细胞的分离与鉴定


一个小小的细胞就有多达4200万个蛋白质分子