科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-30
来源:BioArt
RAF激酶家族通过RAS-RAF-MEK-ERK信号通路调控细胞的增殖、生长、分化和存活。RAF的激活突变常见于多种肿瘤细胞【1-3】。靶向BRAF V600E突变的小分子药物包括达拉菲尼(dabrafenib)、维莫菲尼(vemurafenib)和恩可拉非尼(encorafenib),它们在临床应用中展现了不错的效果,但是耐药性的产生限制了它们的长期使用。这些小分子抑制剂主要通过结合于RAF的催化口袋发挥功能,却不能抑制RAF活化的另一个关键环节——二聚化,因此不能完全抑制RAF的活性【4-9】。 蛋白水解靶向嵌合体(Proteolysis-Targeting Chimeras,PROTACs)利用双功能小分子诱导蛋白质降解,该技术的基本原理在于利用细胞自身的泛素-蛋白酶体系统来达到降解靶标蛋白的目的(详情请见BioArt报道:陈益华团队开发出新型PROTAC蛋白降解剂 | 突破,首个降解KRAS^G12C的高活性PROTAC)。 2020年8月10日,加拿大的Marc Therrien和Frank Sicheri课题组在Nature Chemical Biology杂志发表了题为Functional characterization of a PROTACdirected against BRAF mutant V600E的论文,使用PROTAC降解V600E突变的BRAF,并在细胞和分子水平验证了这种策略PROTAC相对于小分子抑制剂的优越性。 首先,实验人员设计并且合成了一系列可以同时靶向BRAF和不同E3泛素连接酶的PROTAC分子,从中选出了最高效的分子,命名为P4B(图1)。该分子由两部分组成:处于临床前阶段的BRAF抑制剂BI 882370,以及能够结合E3连接酶cereblon的pomalidomide/thalidomide。实验者在人黑色素瘤细胞系A375和HEK293T细胞进行验证,发现小分子的确能够诱导BRAF-P4B-E3三元复合体的形成。该PROTAC可以促进目标蛋白的降解、抑制癌细胞的增殖。
首先,实验人员设计并且合成了一系列可以同时靶向BRAF和不同E3泛素连接酶的PROTAC分子,从中选出了最高效的分子,命名为P4B(图1)。该分子由两部分组成:处于临床前阶段的BRAF抑制剂BI 882370,以及能够结合E3连接酶cereblon的pomalidomide/thalidomide。实验者在人黑色素瘤细胞系A375和HEK293T细胞进行验证,发现小分子的确能够诱导BRAF-P4B-E3三元复合体的形成。该PROTAC可以促进目标蛋白的降解、抑制癌细胞的增殖。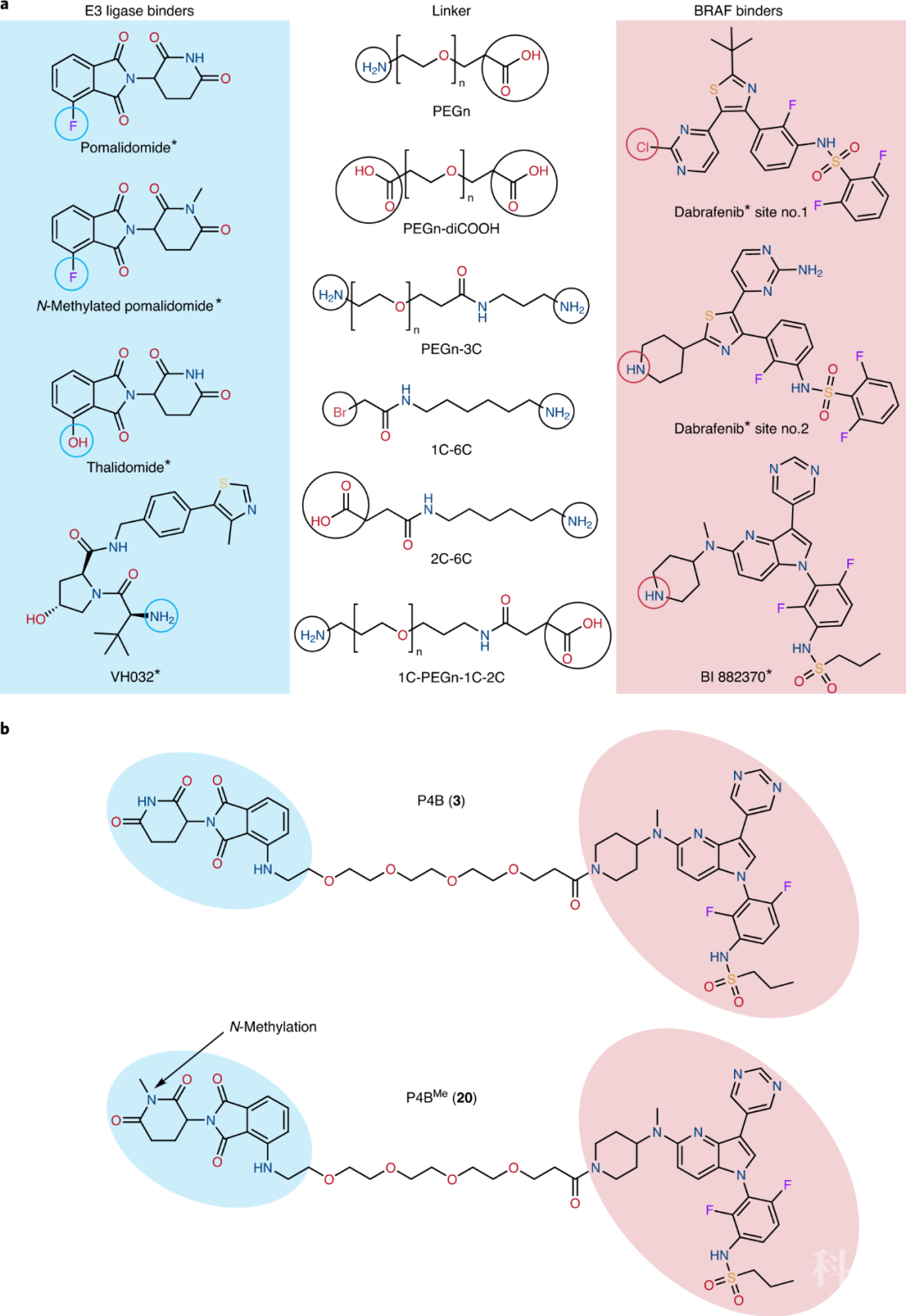 图1. 靶向BRAF的小分子PROTAC(P4BMe作为对照分子,不结合E3连接酶) 进一步,作者还比较了不同肿瘤细胞系(黑色素瘤、肺癌)对P4B分子的敏感度差异。NCI-H1666细胞系携带BRAF的G466V突变,这使它对传统的BRAF抑制剂不敏感。然而,P4B能够很好地对其发挥抑制效果。A375-VR细胞系不仅携带BRAF的V600E突变,还带有BRAF激酶结构域的串联重复突变,致使其对传统的BRAF抑制剂产生耐药。但是,由BRAF抑制剂改造而来的P4B还是能够抑制这些癌细胞的增殖。 然后,研究人员解析了P4B分子与BRAF激酶结构域结合的晶体结构,分辨率为3.29 Å(图2)。从晶体结构中可以看出,P4B的BI 882370部分结合于BRAF的ATP结合口袋,其构象与单独的BI 882370分子的结合模式类似,说明把BI 882370改造为PROTAC后,linker区域和招募E3连接酶的pomalidomide并不影响BI 882370对BRAF的结合。
图1. 靶向BRAF的小分子PROTAC(P4BMe作为对照分子,不结合E3连接酶) 进一步,作者还比较了不同肿瘤细胞系(黑色素瘤、肺癌)对P4B分子的敏感度差异。NCI-H1666细胞系携带BRAF的G466V突变,这使它对传统的BRAF抑制剂不敏感。然而,P4B能够很好地对其发挥抑制效果。A375-VR细胞系不仅携带BRAF的V600E突变,还带有BRAF激酶结构域的串联重复突变,致使其对传统的BRAF抑制剂产生耐药。但是,由BRAF抑制剂改造而来的P4B还是能够抑制这些癌细胞的增殖。 然后,研究人员解析了P4B分子与BRAF激酶结构域结合的晶体结构,分辨率为3.29 Å(图2)。从晶体结构中可以看出,P4B的BI 882370部分结合于BRAF的ATP结合口袋,其构象与单独的BI 882370分子的结合模式类似,说明把BI 882370改造为PROTAC后,linker区域和招募E3连接酶的pomalidomide并不影响BI 882370对BRAF的结合。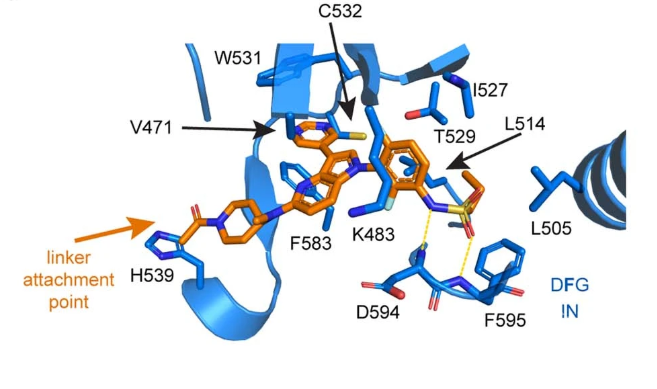 图2. P4B与BRAF激酶结构域的复合体晶体结构这项研究证明,靶向BRAF的PROTAC或许可以为临床上BRAF抑制剂的耐药问题提供新的解决方案。最后,作者指出,由于在细胞中BRAF存在多种状态(自抑制状态的单体或有活性的二聚体),如果PROTAC可以特异性靶向其中一种BRAF构象,那么它们的临床应用价值将会更高。
图2. P4B与BRAF激酶结构域的复合体晶体结构这项研究证明,靶向BRAF的PROTAC或许可以为临床上BRAF抑制剂的耐药问题提供新的解决方案。最后,作者指出,由于在细胞中BRAF存在多种状态(自抑制状态的单体或有活性的二聚体),如果PROTAC可以特异性靶向其中一种BRAF构象,那么它们的临床应用价值将会更高。 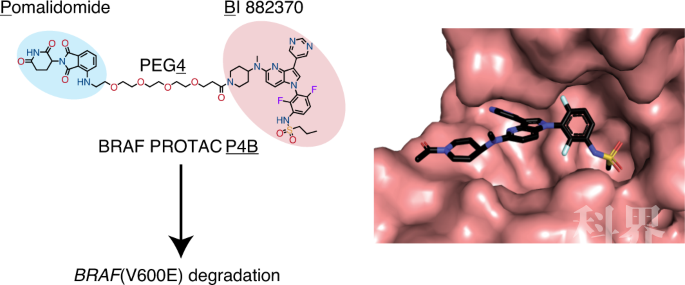
参考文献
Lavoie, H. & Therrien, M. Regulation of RAFprotein kinases in ERK signalling. Nat. Rev. Mol. Cell Biol. 16, 281–298(2015).
Simanshu, D. K., Nissley, D. V. &McCormick, F. RAS proteins and their regulators in human disease. Cell 170,17–33 (2017).
Terrell, E. M. & Morrison, D. K.Ras-mediated activation of the Raf family kinases. Cold Spring Harb. Perspect.Med. 9, a033746 (2019).
Rajakulendran, T., Sahmi, M., Lefrancois, M.,Sicheri, F. & Therrien, M. A dimerization-dependent mechanism drives RAF catalytic activation. Nature 461, 542–545 (2009).
Thevakumaran, N. et al. Crystal structure of aBRAF kinase domain monomer explains basis for allosteric regulation. Nat.Struct. Mol. Biol. 22, 37–43 (2015).
Lavoie, H. et al. Inhibitors that stabilize a closed RAF kinase domain conformation induce dimerization. Nat. Chem. Biol. 9,428–436 (2013).
Karoulia, Z. et al. An integrated model of Rafinhibitor action predicts inhibitor activity against oncogenic BRAF signaling.Cancer Cell 30, 485–498 (2016).
Yao, Z. et al. BRAF mutants evade ERK-dependent feedback by different mechanisms that determine their sensitivity to pharmacologic inhibition. Cancer Cell 28, 370–383 (2015).
Peng, S. B. et al. Inhibition of RAF isoforms and active dimers by LY3009120 leads to anti-tumor activities in RAS or BRAFmutant cancers. Cancer Cell 28, 384–398 (2015)
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652497653&idx=8&sn=b05a41840ef71f9dbaf61677d0e90593&chksm=84e27541b395fc57e7c84de38d8260c5f64ed03e878489b2f0e1376928dccb17c7b1b9051df1#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

蛋白质靶向降解PROTAC疗法的研究进展
微波炉里小分子的大世界
化学链小分子转化研究进展
Adv. Funct. Mater.:摩擦电纳米发电机驱动的柔性药物释放装置
宁波材料所葛子义团队《德国应化》:在全小分子有机太阳能电池研究取得重要进展
Nature | 利用小分子杀死肿瘤干细胞

Nature子刊:BRAF蛋白的特殊修饰能够抑制肿瘤生长
优化PROTAC的新策略:可逆共价
研究揭示烟酸及多种小分子候选药物激活HCAR2的分子机制
小分子晶体养不好?先“找个伴”吧