科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-26
来源:BioArt
原标题:Mol Cell背靠背 | 何川团队报道mRNA与miRNA上存在m7G甲基化修饰
近几年来,哺乳动物信使RNA中的6-甲基腺嘌呤(m6A)甲基化修饰作为丰度最高的修饰类型,其发挥的重要生物学功能吸引了RNA以及表观遗传学领域的广泛关注【1,2】。2016年2月,研究人员发现了另一种甲基化腺嘌呤即1-甲基腺嘌呤(m1A)亦广泛存在于哺乳动物信使RNA(mRNA)中,这种自带正电荷的甲基化修饰以其自身的电子效应及空间效应,对mRNA的二级结构和蛋白-RNA相互作用构成潜在影响【3,4】。然而,对于另一种已知的自带正电荷的RNA甲基化修饰7-甲基鸟嘌呤(m7G),人们对于其在哺乳动物mRNA内部(internal m7G)和miRNA的存在性及相关生物学功能尚不清楚。
2019年4月25日,美国芝加哥大学的何川教授和英国剑桥大学的Tony Kouzarides教授在同期Molecular Cell发表m7G相关研究,发现m7G存在于miRNA和mRNA内部并发挥重要作用。
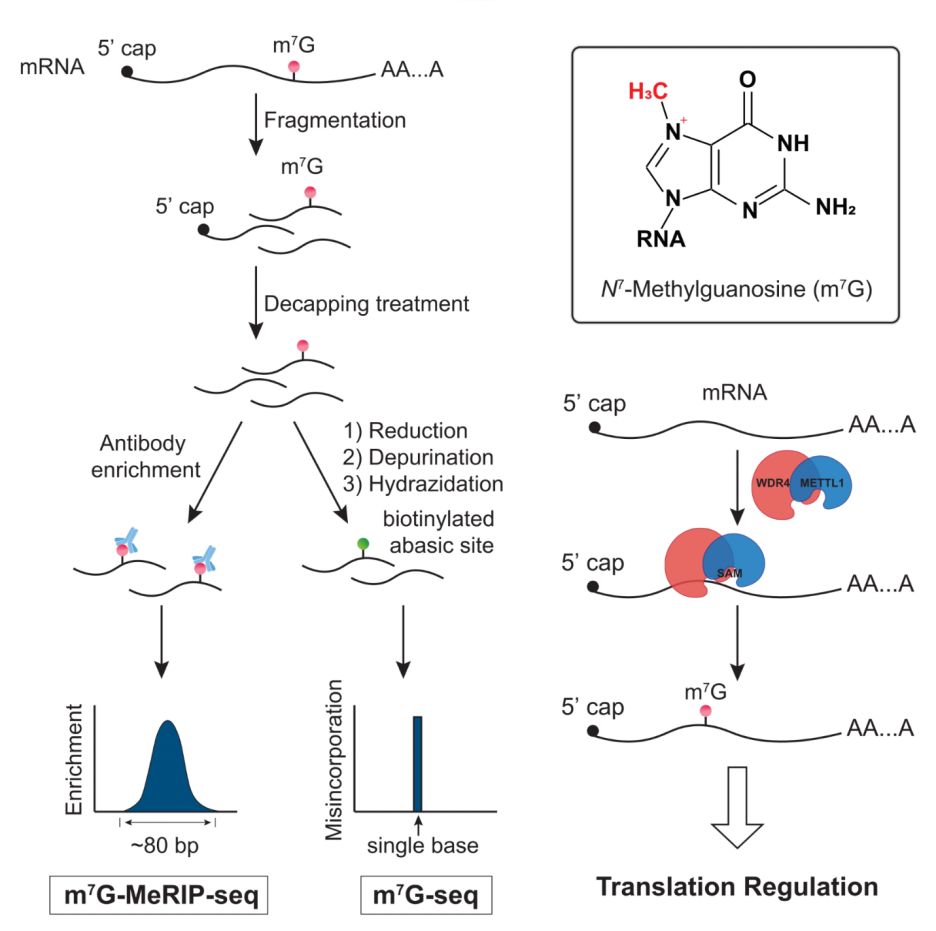
何川教授团队的研究:Transcriptome-wide Mapping of Internal N7-Methylguanosine Methylome in Mammalian mRNA,报道了信使RNA内含m7G的存在性及单碱基精度的m7G测序方法、相关甲基化转移酶和功能研究。

众所周知,信使RNA 5’端帽m7G以共转录甲基化的方式参与形成mRNA关键的5’末端结构【5】,可提高mRNA稳定性并调控mRNA转录、pre-mRNA剪接、3’多腺苷酸化、细胞核输出和mRNA翻译等诸多重要的生物学机制。除了存在于5’端帽结构,内含m7G也被证实广泛存在于转运RNA(tRNA)和18S核糖体RNA(rRNA)中。在人类细胞中,METTL1-WDR4甲基化转移酶复合体可产生tRNA第46位的m7G,并与tRNA稳定性和人类疾病密切相关【6,7】;WBSCR22甲基化转移酶可对18S rRNA第1639位的m7G位点进行甲基化修饰,进而调控18S rRNA的核内加工及成熟【8,9】。面对细胞里诸多的m7G甲基化转移酶体系和一系列5’端帽m7G的识别蛋白,哺乳动物mRNA的内含m7G(internal m7G)的存在性很有可能会揭示一些新的生物学功能和机理。
芝加哥大学的研究人员首先运用高效液相色谱仪-串联三重四极杆质谱技术(LC-MS/MS)对于mRNA的内含m7G进行了定量研究,借助于不同种类核酸酶工作于信使RNA的5’端帽结构和其内部区域的活性差异【10】,鉴定出(在几种实验室常见的人类或老鼠细胞系中)mRNA内含m7G丰度约为 0.02%至0.05%(m6A的丰度约为0.1-0.4%【11】)。随后,研究者利用特异选择性优良的anti-m7G抗体对去5’端帽的mRNA片段(decapped mRNA fragments)实施了传统的MeRIP-seq (甲基化RNA免疫沉淀测序)以观测mRNA内含m7G的统计特征,并发现该甲基化修饰主要富集于信使RNA的3’ UTR区域并呈现出GA富集的共有序列(sequence motif)。研究人员进一步开发了基于化学方法的内含m7G单碱基精度测序方法,由于m7G中7位甲基不在碱基配对一侧(m1A测序中主要利用了m1A甲基显著干扰碱基配对【3,4,12】),RNA内含m7G位点在几乎所有种类的反转录酶读取下均无法产生任何对应cDNA中的碱基变异(misincorporation),这就要求作者开发新的测序方法将RNA内含m7G位点转化为另一种可产生反转录碱基变异(RT misincorporation)的新位点,并旨在依据可靠的碱基变异率估计内含m7G位点的甲基化水平(methylation fraction)。

何川团队研究人员基于其之前运用化学手段实现mRNA上单碱基精度Nm-seq测序的思路【13,14】,利用m7G自带正电荷的特征,运用化学还原剂硼氢化钠(NaBH4)将其转化为还原态m7G,进而在酸性溶液(pH 4.5)中加热促使还原态m7G中嘌呤环离去形成RNA上的缺嘌呤位点(AP site),这一步温和而有效的去嘌呤化可选择性移除m7G中嘌呤环而不影响其它碱基如A、U、C、G或其它甲基化的G。对于生成的RNA缺嘌呤位点,由于其含有的活性醛基结构,可与装配有生物素(biotin)的酰肼反应生成带有biotin基团的AP位点,从而进一步被富集。对于未经化学处理的RNA测序样品,内含m7G位点不体现反转录碱基变异(RT misincorporation);而对于内含m7G位点产生的缺嘌呤位点则会在特定反转录酶(HIV reverse transcriptase)作用下产生RT misincorporation,被biotin进一步富集的缺嘌呤位点则会在反转录过程中体现出更高的碱基变异率。综上所述,如果一个RNA的鸟嘌呤G位点在无化学处理条件下(input)无反转录碱基变异,而在化学处理后产生RT misincorporation以及biotin富集后的更高碱基变异率,则此G位点被鉴定为RNA内含m7G候选位点,此测序方法被命名为m7G-seq。
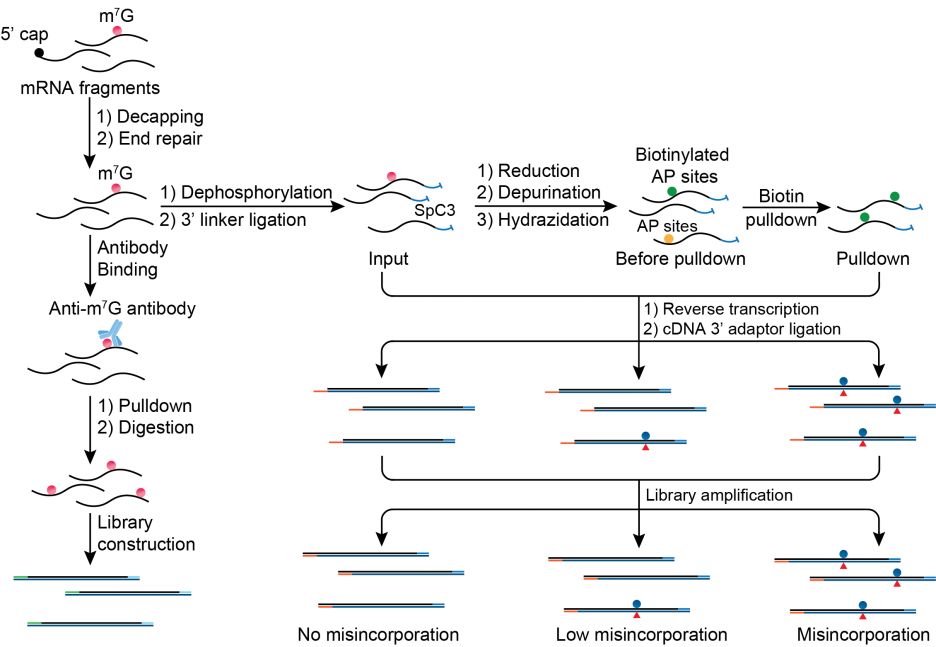
在以上设计的基础之上,研究者详细筛选和优化了m7G-seq建库流程,首先运用植物中的去5’端帽酶(tobacco decapping enzyme)去除mRNA末端m7G,然后借助于PNK末端修复和去磷酸酶作用确保了3’端羟基以及移除了会与biotin酰肼反应的磷酸基团,并将所有的修复、连接等步骤都设置在缺嘌呤位点产生之前以确保AP site在体系中的稳定存在,在缺嘌呤位点产生之后迅速进行HIV反转录将RNA转化为对应的cDNA。此方法随后被证实可高效检测18S rRNA中的1639位内含m7G位点以及可揭示人类细胞tRNA中的22个46位内含m7G位点,在未经biotin富集之前体现出5%至31%的碱基变异率(misincorporation rate),主要为G→T和G→C变异,对应60%到接近100%的甲基化水平;在biotin富集之后呈现出18%至60%的碱基变异率,进一步印证了内含m7G的测序特征。对于其它tRNA中甲基化G诸如m1G、m2G或m22G,由于其在input、未经biotin富集之前和biotin富集之后的三种状态中均体现一致的高碱基变异率或一致的无碱基变异率,可与内含m7G位点精确区分。进一步的,当对于tRNA的46位m7G甲基转移酶METTL1进行敲落处理(knockdown)后,m7G-seq可以有力捕捉该位点碱基变异率的下降【15】。
得到了以上数据作为方法上的验证,研究人员随即展开了对于信使RNA内含m7G的单碱基精度测序工作,基于常见的人类HeLa细胞系和HepG2细胞系,在未经biotin富集实验组中,两细胞系共有的超过40个高甲基化水平的mRNA上内含m7G位点得以鉴定,同时被biotin富集后的实验组测序数据所证实。为了进一步揭示mRNA上低甲基化水平的或者动态的内含m7G位点,研究者研究了biotin富集后的内含m7G位点,并发现了大约800个两细胞系共有的信使RNA内含m7G候选位点,并观测到其在mRNA分布、富集的共有序列(sequence motif)及其它统计特征与之前获得的m7G-MeRIP-seq数据基本保持一致。
在测序结果的基础之上,作者在两个细胞系中运用MeRIP-seq对m7G甲基转移酶METTL1敲落处理前后的mRNA进行了测序及分析,发现在几千个抗体富集程度(enrichment folds)受到影响的内含m7G位点中,均有超过75%的位点富集程度显著下降, 说明了METTL1可对于mRNA上一部分内含m7G位点产生甲基化效应。并且,体外甲基化酶活实验证实了METTL1-WDR4复合体在对mRNA进行处理之后,可显著提升数倍其内含m7G/G的水平。此后,对于这些在METTL1敲落处理后甲基化水平下降的内含m7G(hypo-methylated)位点,研究人员又在核糖体印记测序(Ribo-seq)中观察到其对应的mRNA翻译水平在METTL1敲落后的下降(相比于非内含m7G位点对应的mRNA),提示了内含m7G对于mRNA翻译的潜在影响。
那么,是否存在相关阅读蛋白(reader)实现了内含m7G对mRNA翻译的调控呢?该研究没有给出答案。确实,寻找和鉴定RNA修饰的阅读蛋白,已成为解释该修饰功能的通用方法。然而,今年3月18日,清华大学的张强锋教授在Nature Structure & Molecular Biology发表研究“RNA structure maps across mammalian cellular compartments”,发现RNA的结构可直接影响转录和翻译的效率。而正如前文提到,m1A修饰通过其自身携带正电荷影响RNA的二级结构,而m7G同样也是带有正电荷的化学修饰,那么内部m7G对翻译的调控,是依赖于相关阅读蛋白完成的,还是通过改变RNA的二级结构实现的呢?RNA结构的解析或将成为解释RNA修饰功能的新方向。期待更多相关的研究解答我们的疑惑。
综上所述,本文阐释了一种新型mRNA甲基化修饰内含m7G的存在并开发了相应的测序方法,其中蕴含的依靠化学处理而产生的反转录碱基变异,对RNA单碱基精度测序的相关研究提供了新的思路,希望与此文相关的进一步研究会得到广泛的关注和支持。
剑桥大学Tony Kouzarides教授的研究“METTL1 Promotes let-7 MicroRNA Processing via m7G Methylation”,发现METTL1介导了miRNA的m7G修饰并参与肺癌的进程。

研究者采用化学反应的方法在一批miRNA上鉴定到m7G修饰,并且也是由甲基转移酶METTL1介导的。METTL1介导的miRNA m7G修饰,在肺癌中发挥重要功能,可抑制癌细胞的迁移能力。(可惜的是研究者未排除METTL1作用于mRNA带来的影响)
有趣的是,miRNA虽然短小,但是调控它的修饰却很丰富,目前已报道的修饰类型还包括RNA A-to-I编辑【16】和m6A修饰【17】,那么这3个修饰间是否存在cross talk,共同调控miRNA的表达量呢?未来有关RNA修饰间的cross talk研究将帮助我们更全面的了解miRNA的加工过程。
总的来说,这两项研究展示了m7G不仅仅是mRNA5’端帽子结构,也同时广泛存在于mRNA内部和miRNA上,并且发挥着重要的生理功能。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469260&idx=3&sn=b3a6fc87e35ae32f238c5d43e4b37c2b&chksm=84e2ebb8b39562ae30bb0f0f09bcf4101e67542c4edbf2972f29013ac43dcfe1a29f756fb11f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

昆士兰大学助力信使RNA递送的新兴纳米生物技术
剪接体分子机器和信使RNA前体剪接循环

继Nature封面,付向东等团队发现了线粒体存在RNA干扰
(三甲基甲硅烷基)甲基胺
再创|基因线路的设计原则(一)
助力信使RNA递送的新兴纳米生物技术
4-(羟甲基)环己基甲基乙烯醚
手性阴离子催化的不对称氨甲基化反应构建α-季碳-α-羟基-β2-氨基酸衍生物

武汉病毒所发现RNA干扰具有抗病毒免疫作用

【科技前沿】付向东/张晓荣发现线粒体存在RNA干扰,为进一步研究线粒体生物学奠定基础