科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-07
来源:BioArt
责编 | 酶美
蛋白质液态-液态相分离(liquid-liquid phase separation),简称相分离,是多种执行重要生物学功能的无膜细胞器(membrane-less organelles) 和生物分子聚集体(biomolecular condensates)动态组装的主要驱动力。对其深入的研究逐步构建了近年来细胞生物学领域的一个重要的新理论和新方向,并且获得越来越多的实验证据支持。例如:BRD4和MED1在超级增强子处通过发生相分离来调控转录【1】;HP1的相分离在异染色质组装和调控中起关键作用【2】;Synapsin的相分离促进突触小泡在轴突突触前膜的 clustering等【3】。蛋白质的相分离在细胞内受到精密的调控。相分离调控的紊乱,会直接造成多种RNA结合蛋白的不可逆聚集,最终导致重要人类疾病(如渐冻人症)的发生【4】。
目前,本领域的研究主要集中在发现和描述各种新的蛋白相分离现象,及其在所参与的生物学过程中的重要作用。而对蛋白相分离动态组装的分子机制和结构基础,以及细胞内精密调控的分子机理的研究相对匮乏,从而阻碍了对相关疾病发生的分子机制的理解。
上海交通大学Bio-X研究院李丹课题组和上海有机化学研究所生物与化学交叉中心刘聪课题组长期合作致力于研究蛋白质相分离和淀粉样聚集的结构基础与分子机制。前期合作研究发现,渐冻人症致病蛋白FUS可以形成有别于致病淀粉样聚集的可逆的淀粉样结构,并阐释其在FUS的相分离中起到的重要作用【5】(详见BioArt报道:0.73Å,最高分辨率的结构揭示淀粉样聚集蛋白功能性可逆的精密调控分子机制)。近期,两个课题组进一步合作,在原有工作的基础上发现另一个重要的渐冻人症致病蛋白hnRNPA1在相分离的过程中形成高度可逆的淀粉样聚集体,并阐释了该可逆聚集体对hnRNPA1相分离的调控作用。相关工作以Structural basis for reversible amyloids of hnRNPA1 elucidates their role in stress granule assembly为题于2019年5月1日发表在Nature Communications【6】。

hnRNPA1、FUS等RNA结合蛋白广泛参与细胞核内RNA的稳态调控。在细胞感受到外部压力刺激时,相应蛋白可从细胞核穿梭到细胞质中发生可逆的相分离,参与压力颗粒的形成。然而,在病理条件下,蛋白的可逆组装发生异常,hnRNPA1、FUS等蛋白会进一步聚集,形成病理性不可逆的淀粉样纤维。这一过程与渐冻人症(ALS)、额颞叶痴呆症(FTD)等神经退行性疾病的发生密切相关。
本工作发现,在hnRNPA1体外相分离形成的液滴中存在高度可逆的淀粉样纤维,其动态组装/去组装与hnRNPA1的相分离高度同步。荧光漂白和单分子光镊等实验揭示可逆纤维的形成对hnRNPA1液滴的流动性、可融合性等物理性质有决定性的影响。本工作进一步采用独特的蛋白微晶电子衍射技术(MicroED),以及Rosetta结构模拟等方法,解析了hnRNPA1形成可逆淀粉样纤维的三段核心肽段的高分辨原子结构。结构揭示了一种新颖的含有天冬氨酸有序排列的立体拉链结构(命名为D-ladder)。D-ladder合理地解释了其所形成纤维结构的高度可逆性。更为重要的是,D-ladder的关键氨基酸(即天冬氨酸)正是在一类家族性遗传渐冻人症患者中被鉴定出的致病突变位点(D262V/N)。该研究工作表明,这一家族突变会直接导致hnRNPA1纤维可逆性的丧失,造成相分离液滴的固化,以及致病性不可逆纤维的积累。
综上,该工作发现了一类新的可逆淀粉样纤维核心结构,阐释了可逆淀粉样纤维对于蛋白相分离的重要调控作用,并探究了可逆纤维在病理条件下由于突变导致不可逆淀粉样纤维形成的结构基础,为理解蛋白相分离紊乱引起的相应疾病的发病机理提供分子理论依据。
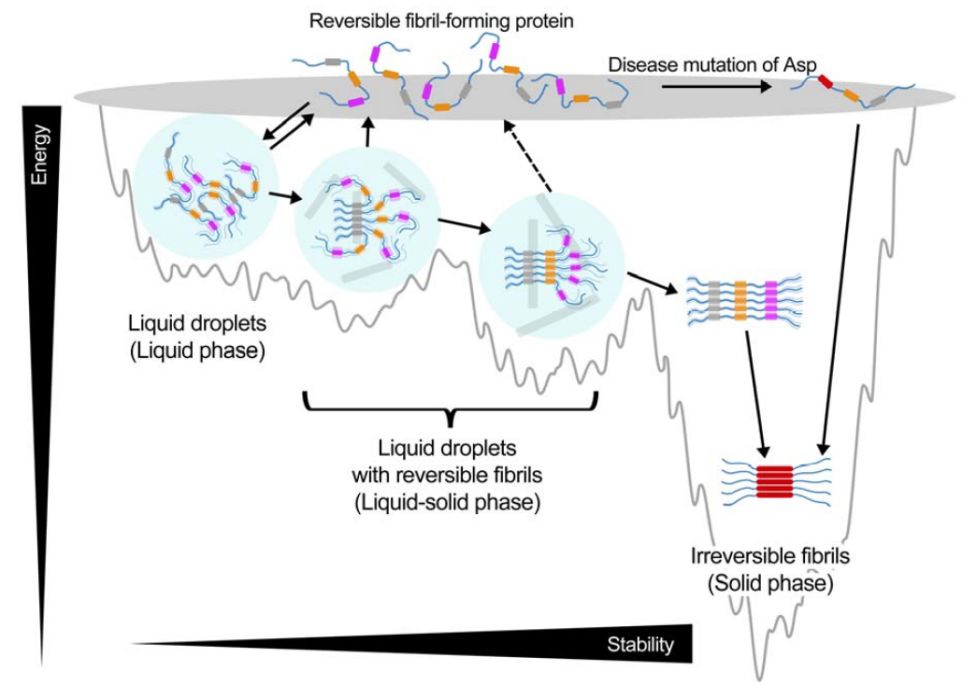
图:蛋白相分离、可逆淀粉样纤维和不可逆淀粉样纤维的形成过程【6】。
值得一提的是,刘聪课题组与上海有机化学研究所生物与化学交叉中心方燕珊课题组合作,开展了另外一项hnRNPA1蛋白相分离相关的研究,发现了细胞内一种蛋白翻译后修饰—— ADP核糖基化修饰 (Poly(ADP-ribosyl)ation, PARylation) 对hnRNPA1相分离的重要调控机制。该工作阐释了hnRNPA1可以通过直接结合PAR或者被PARylation共价修饰两种不同的方式来调控hnRNPA1自身的相分离、细胞核质间转运、以及参与压力颗粒的组装和调控。该工作在今年2月的Cell Research上发表【7】。

另外,刘聪和方燕珊两位研究员于近期受邀在Biochemical Pharmacology杂志上撰写了题为“New insights of poly(ADP-ribosylation) in neurodegenerative diseases: a focus on protein phase separation and pathologic aggregation”的综述文章,系统总结和展望了PARylation在调控蛋白相分离和致病淀粉样聚集中的作用,及其与多种神经退行性疾病的关系【8】。

制版人:半夏
参考文献
1. Sabari B, et al., Coactivator condensation at super-enhancers links phase separation and gene control. Science. 2018 Jul 27;361(6400)
2. Strom AR et al., Phase separation drives heterochromatin domain formation. Nature. 2017 Jul 13;547(7662):241-245.
3. Milovanovic D, et al., A liquid phase of synapsin and lipid vesicles. Science. 2018 Aug 10;361(6402):604-607
4. Boeynaems S, et al., Protein Phase Separation: A New Phase in Cell Biology. Trends Cell Biol. 2018 Jun;28(6):420-435.
5. Luo F, et al., Atomic structures of FUS LC domain segments reveal bases for reversible amyloid fibril formation. Nat Struct Mol Biol. 2018 Apr;25(4):341-346.
6. Gui X, et al., Structural basis for reversible amyloids of hnRNPA1 elucidates their role in stress granule assembly. Nat Commun. 2019 May 1;10(1):2006.
7. Duan Y, et al., PARylation regulates stress granule dynamics, phase separation, and neurotoxicity of disease-related RNA-binding proteins. Cell Res. 2019 Mar;29(3):233-247.
8. Liu C, Fang Y. New insights of poly(ADP-ribosylation) in neurodegenerative diseases: a focus on protein phase separation and pathologic aggregation. Biochem Pharmacol. 2019 Apr 26
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469555&idx=4&sn=48177872dbad01e2e020fe309650bac1&chksm=84e2ea87b39563917c01d1fcda18eb36edbc237c208a422bfb9cfcb130bdd81d0e9e614dacc1&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
关于举办“环境友好的农林害虫生态调控与生物防治技术高级研修班”通知
渐冻症会遗传吗?

【科学普及】走近渐冻症
了解渐冻症,关爱渐冻人

微生物与“渐冻症”之间存在联系

比癌症还要残忍的疾病,正是罕见的“渐冻症”
早发型“渐冻症”致病基因揭示
环境友好的农林害虫生态调控与生物防治技术——2017高级研修班总结
Molecular Plant 出版“植物激素”专辑

上海有机所揭示RNA调控渐冻人症致病蛋白TDP-43形成应激核体