科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-07
来源:BioArt
真核细胞在进行细胞分裂时,除了需要将遗传物质,也就是DNA序列进行精确复制,还需要将表观遗传信息传递给下一代,从而控制细胞命运。表观遗传信息包括DNA修饰(甲基化等),组蛋白翻译后修饰,非编码RNA和染色质高级结构等。其中,组蛋白作为构成核小体的骨架单位,其翻译后修饰的调控及遗传机制受到广泛关注。
染色质复制时,随着遗传物质的加倍,组蛋白也需要加倍,从而满足核小体组装的需求。之前的研究表明,新合成组蛋白将携带和父本组蛋白截然不同的翻译后修饰。子代细胞需要重建表观遗传状态,从而维持细胞的表型或进行分化,因此组带白修饰向新合成DNA链的精确传递就显得尤为重要。早期的研究者们推测,父本组蛋白随机等分到新合成的两条DNA上,即前导链(leading strand)和滞后链(lagging strand)得到相等数量和相同状态的父本组蛋白,但该理论并未得到实验证据支持。
为了深入探讨这一过程及其调控机制,哥伦比亚大学医学院张志国教授课题组于传贺和甘海云博士等人数年前开发了eSPAN方法,通过二代测序对某一蛋白质(包括带特定修饰的组蛋白)在酵母细胞中的复制叉两条子链的结合进行定量【1】。通过这一方法首次证明,父本组蛋白在前导链和滞后链上的分布并不是完全随机和对称【2,3】。Dpb3和Dpb4,作为前导链DNA聚合酶Polε的亚基,介导父本组蛋白向前导链上的转移,而MCM2-Ctf4-Polα这一条通路则促进父本组蛋白向滞后链的转移。
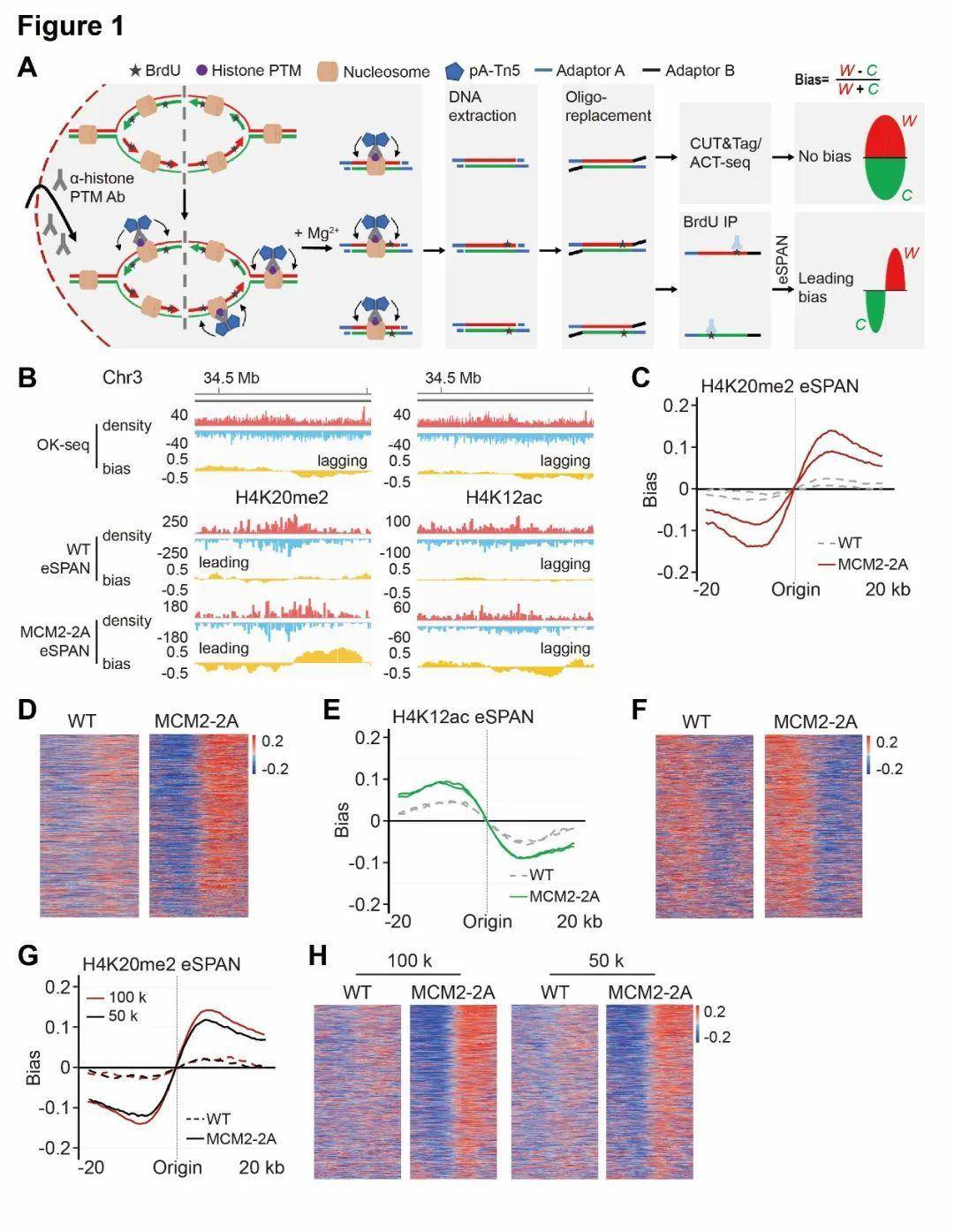 图1. eSPAN工作模式图
图1. eSPAN工作模式图
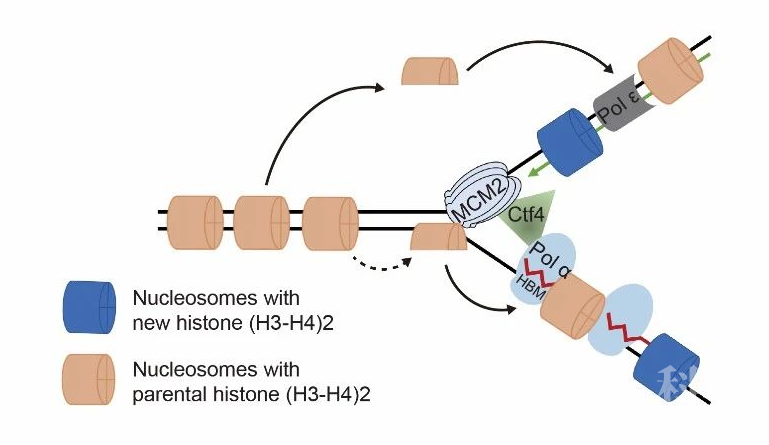 图2. 父本组蛋白向前导链和滞后链转移的两条分子通路
图2. 父本组蛋白向前导链和滞后链转移的两条分子通路来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652498542&idx=5&sn=96d1ba4feb6611ab742e0a87200a581d&chksm=84e279dab395f0ccdee9fafaf4dc79d840b8de5a0e76255849453f822dde75ea92aaed782a65#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Nature、PNAS齐发文,线粒体DNA竟然可以双亲遗传

DNA测序打破罕见遗传病诊断速度纪录
合成生物学: 一个用来控制转基因生物的内置毁灭开关
DNA——独一无二的生命遗传乐章

DNA“纳米转运蛋白”或可高效治癌
科学家发现“强势”染色体以“欺骗”手段进入卵细胞
DNA甲基化跨代遗传研究取得进展
日本流行DNA相亲,靠遗传基因决定“本命”

科学家解密神经如何自我修复,有望治疗人类神经损伤
演化:“最奇怪动物”身份揭秘