科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-16
来源:X一MOL资讯
探索天然产物生源合成途径对于天然产物合成以及化学生物学研究具有重要意义。例如生源合成途径中的“环化/后期氧化”(cyclization/late-stage P450-mediated oxidation)策略被运用于一系列具有抗癌活性二萜的全合成中。生源合成上,从共同的生源前体香叶基香叶基焦磷酸(GGPP, 1, 图1A)出发,通过萜类环化酶(terpenoid cyclase)催化的多步碳正离子环化和重排反应可产生各种二萜类天然产物(Nat. Prod. Rep., 2011, 28, 1035–1053),例如抗癌药物紫杉醇(Taxol)、巨大戟醇(ingenol)和抗生素截短侧耳素(pleuromutilin)。因此,人们对二萜类天然产物的生物合成和仿生合成进行了广泛的研究。
北京大学雷晓光课题组在前期的工作基础之上(Angew. Chem. Int. Ed., 2016, 55, 3112-3116; J. Nat. Prod., 2018, 81, 298−306),近期对香茶菜属(Isodon)二萜的合成研究取得一系列新的重要进展,完成了5个香茶菜属二萜分子的首次不对称全合成,并且发现由紫外光或自然光引发的[3.2.1]桥环骨架自由基重排反应可以高效促发二萜类天然产物的骨架重排,从而揭示了该自由基重排——而非传统上认为的碳正离子重排——是该类天然产物可能的生物合成过程。研究成果分别在线发表于Chem 杂志 [1] 和Angew. Chem. Int. Ed.杂志 [2]。雷晓光课题组洪本科博士、刘伟龙博士和博士生王进为 Chem 文章共同第一作者,北京大学余志祥课题组与山东大学娄红祥教授为该研究工作提供了帮助。博士生吴金宝和日本籍博士后Yuichiro Kadonaga博士为Angew. Chem. Int. Ed.文章共同第一作者。该系列工作得到国家自然科学基金(杰出青年基金、重点项目、和创新群体项目)、科技部重点研发计划、973项目、以及北大-清华生命联合中心的资助。
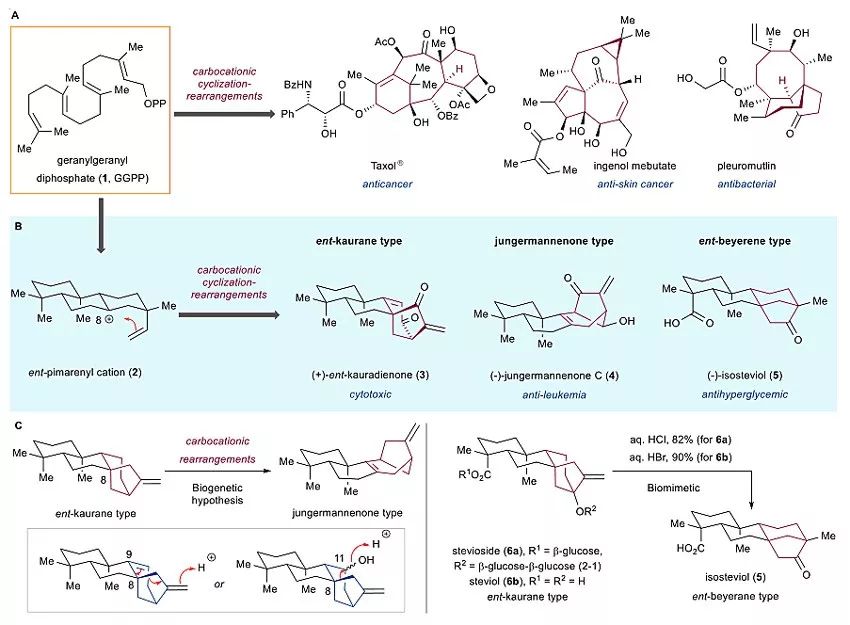
图1. 二萜类天然产物的结构、生源途径和骨架重排。图片来源:Chem [1]
香茶菜属二萜是一类结构复杂的多环活性天然产物,迄今为止已分离鉴定出1000多种该家族天然产物。与诸多其他二萜天然产物一样,其生源合成是从GGPP(1)出发,通过一些列酶促环化反应得到共同的生源前体2,随后通过碳正离子重排得到已知的香茶菜属二萜结构,包括ent-kaurane型(3)、jumgermannenone型(4)和ent-beyerene型(5)(图1B)(Chem. Soc. Rev., 2010, 39, 2847–2854)。生源推测不同类型香茶菜属二萜的骨架之间的转化也是通过碳正离子重排实现的。例如最初的生源途径认为,jungermannenone型是从ent-kaurane 型通过两种可能的碳正离子重排而来(图1C)。Hanson课题组和Baran课题组正是受到这类碳正离子重排生源途径的启发,他们成功地将ent-kaurane型二萜stevioside(6a)(Phytochemistry, 1990, 29, 2712–2715)和steviol(6b)(Angew. Chem. Int. Ed., 2013, 52, 9019–9022)通过酸催化的碳正离子重排反应转化为ent-beyerene型二萜isoteviol(5)。
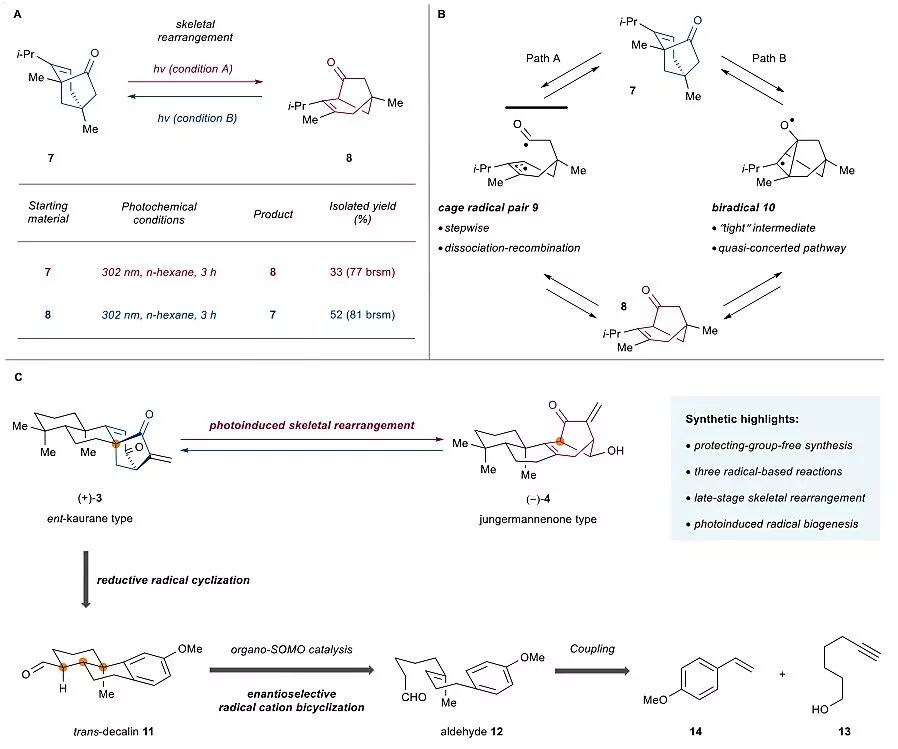
图2. 光引发的[3.2.1]桥环骨架重排。图片来源:Chem [1]
受到上述生源途径以及Hansan和Baran课题组成功的仿生转化的启发,作者开始着手研究ent-kaurane骨架到jungermannenone骨架的重排转化。他们首先以化合物7为模型底物,经过大量的条件筛选,最终发现在302 nm紫外光的照射下,7以33%的收率转化为目标产物8,8在相同的条件下以52%的收率转化为7(图2A)。该紫外光引发的[3.2.1]桥环骨架重排反应可能通过β,γ不饱和酮的1,3酰基迁移实现(J. Org. Chem., 1969, 34, 450–454; Chem. Rev., 1976, 76, 1–74),前期的机理研究表明该重排反应可能经过两种自由基反应途径(J. Am. Chem. Soc., 1978, 100, 6278–6280; J. Am. Chem. Soc., 1982, 104, 2456–2466; J. Am. Chem. Soc., 1986, 108, 5527–5530; J. Am. Chem. Soc., 1996, 118, 176–184; Angew. Chem. Int. Ed., 2017, 56, 12498–12502):经过自由基对(cage radical pair)中间体9的分步过程和双自由基(diradical)中间体10的准协同过程(quasi-concerted pathway)(图2B)。
在天然产物的生源合成途径中自由基过程并不罕见,例如ε-viniferin(Science, 2016, 354, 1260–1265)和pyrrole-imidazole型生物碱(Science, 2014, 346, 219–224)在生源上都经过自由基中间体。近年来,Maimone课题组运用自由基串联环化反应高效地完成了蛇孢菌素二倍半萜(ophiobolin sesterterpene)(–)-6-epi-ophiobolin N 的合成(Science, 2016, 352, 1078–1082);Trauner课题组通过紫外光照的条件完成了intricarene的仿生合成(Nat. Commun., 2014, 5, 5597)。而在推测的香茶菜属二萜的生源合成途径中并不涉及光照或自由基的过程。作者推测ent-kaurane骨架和jungermannenone骨架可以通过后期的(late-stage)紫外光引发的[3.2.1]桥环骨架重排相互转化,并且可能在太阳光下自发的发生,这可能为香茶菜属二萜提供另一种可能的生源途径。为了证实这一猜想,作者开始着手复杂的ent-kaurane 型二萜3和jungermannenone型二萜4的合成,逆合成分析见图2C。
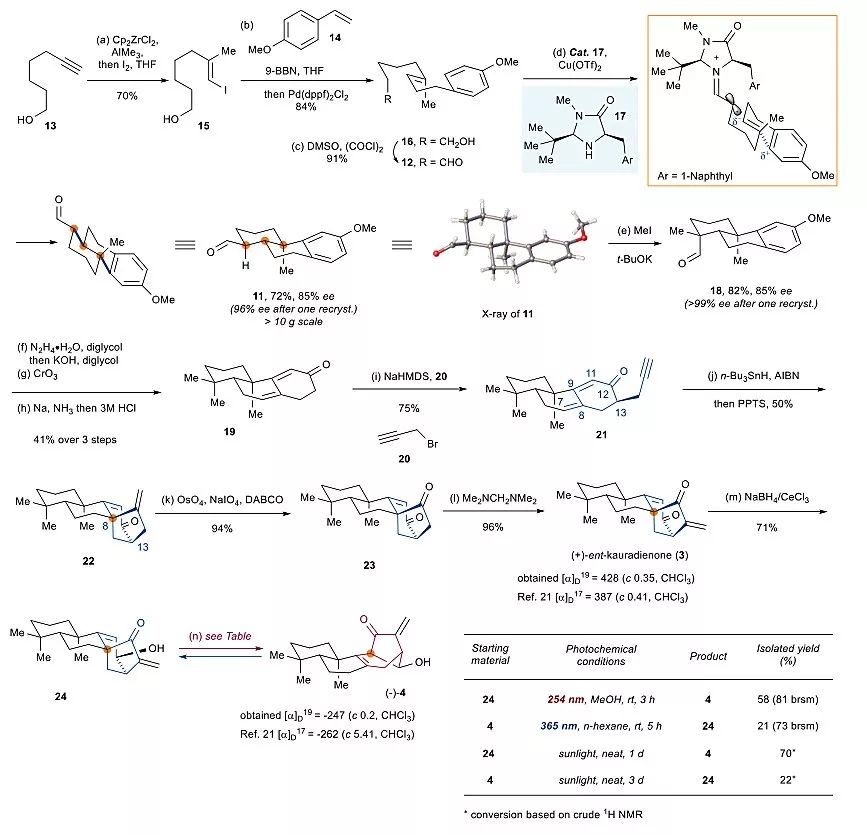
图3. 香茶菜属二萜3和4的无保护基合成。图片来源:Chem [1]
作者从商业可得的醇13开始(图3),通过3步反应得到醛12,12经过对映选择性的SOMO自由基环化反应以78%收率和85% ee值得到11,经过一次重结晶后ee值可以提高至96%,并且通过单晶确定了其绝对构型,11随后通过5步反应得到烯炔中间体16,经过自由基还原环化反应构建出ent-kaurane骨架产物22,最后通过氧化切断环外双键和α-亚甲基化完成了ent-kaurane类型二萜(+)-ent-kurandienone(3)的首次不对称合成。3经过选择性的Luche还原后得到关键ent-kaurane 骨架中间体24,24在254 nm紫外光的照射下,能够以58%的收率顺利得到jungermannenone型二萜(-)-jungermannenone C(4)并回收28%原料24。(-)-jungermannenone C(4)在365 nm紫外光的照射下,可以21%的收率生成24并回收71%的原料4。为了进一步验证ent-kaurane 型二萜和jungermannenone型二萜的生源关系,作者发现当把24和4直接用太阳光照射时,二者仍可顺利地相互转化。至此,作者分别以12步和14步高效完成了(+)-ent-kurandienone(3)和(-)-jungermannenone C(4)的首次不对称全合成,整个合成路线中没有使用任何保护基团。此外,从24和4在太阳光下的相互转化来看,24也可能是天然产物。

图4. 萜类的后期光照骨架重排。图片来源:Chem [1]
作者将该紫外光引发的[3.2.1]桥环骨架重排反应应用于其他ent-kaurane 型二萜、jungermannenone型二萜或其衍生物上(图4)。ent-kaurane 型二萜25和26在紫外光照射下可顺利转化为jungermannenone型骨架产物27和28。反之,27和28也可顺利转化为ent-kaurane 型产物25和26。6,7-seco-ent-kaurane型化合物29可以转化为30,反之亦然。随后,作者发现该骨架重排反应在倍半萜santonide(31)和parasantonide(32)上也可顺利发生,分别生成33和34。而烯胺35在紫外光照射下只可生成单一产物36。这些重排的萜类产物的结构首先由二维核磁确定,其中rac-4、28、30、33、34 和36的结构由单晶衍射进一步确认。
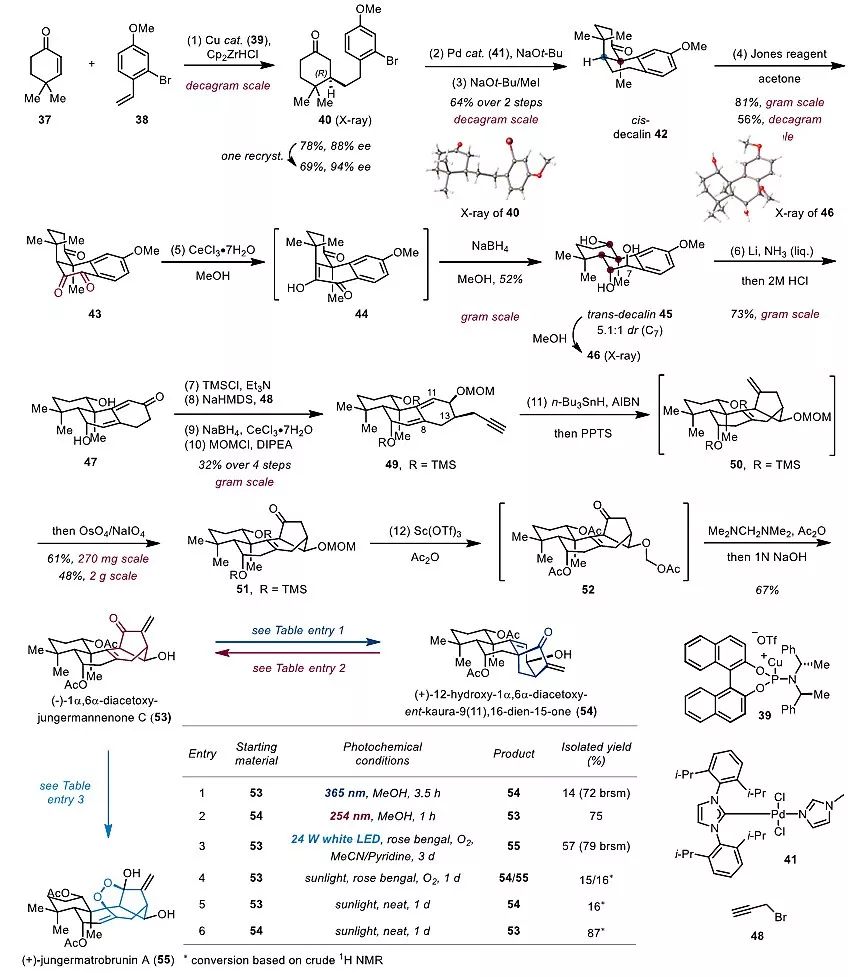
图5. 高氧化态香茶菜属二萜 53、54和55的合成。图片来源:Angew. Chem. Int. Ed. [2]
同时,作者在高氧化态香茶菜属二萜的合成中也取得了重要进展,非常高效的完成了(-)-1α,6α-diacetoxyjungermannenone C(53)、(+)-12-hydroxy-1α,6α-diacetoxy-ent-kaura-9(11),16-dien-15-one(54)和(+)-jungermatrobrunin A(55)的首次不对称合成(图5)。从商业可得的原料37出发,首先通过不对称的Michael加成反应以88% ee得到40,经过重结晶后ee可提高至94%,并且通过单晶衍射确定了绝对构型。40经过钯催化的α-芳基化和甲基化得到顺式十氢萘产物42。42经过Jones氧化和硼氢化钠还原获得反式十氢萘产物45,并且一步构建出4个手性中心。随后经过5步反应得到烯炔中间体49,49通过自由基还原环化反应构建出jungermannenone骨架51,最后通过脱保护和亚甲基化后,以12步完成了(-)-1α,6α-diacetoxyjungermannenone C(53)的合成。作者发现在365 nm紫外光的照射下,(-)-1α,6α-diacetoxyjungermannenone C (53)可顺利转化为ent-kaurane型二萜(+)-12-hydroxy-1α,6α-diacetoxy-ent-kaura-9(11),16-dien-15-one(54);而在254 nm紫外光照射下,54也可顺利转化为jungermannenone型二萜53。53经过可见光介导的Schenck ene 反应可得到过氧桥环天然产物(+)-jungermatrobrunin A(55)。由于53、54和55分离自同一种植物,而自然界中的太阳光同时含有紫外光和可见光,作者认为53、54和55在生源上可能是在太阳光的照射下相互转化而来。事实上作者发现53在光敏剂和氧气的条件下,在太阳光照射下会同时得到54和55。而在太阳光的直接照射下,53和54会顺利地相互转化。这进一步表明ent-kaurane型二萜和jungermannenone型二萜在生源上可能由紫外光引发的[3.2.1]桥环骨架自由重排反应相互转化而来。
小结
雷晓光课题组非常高效地(12-14步)完成了5个香茶菜属(Isodon)二萜首次不对称合成。在合成中多次使用了高效的自由基化学反应,其中包括后期的光照[3.2.1]桥环骨架自由基重排反应。该反应被应用于一系列复杂萜类天然产物或类似物的后期骨架重排中,表明其具有良好的适用性和官能团耐受性。该发现不但揭示了紫外光或自然光引发的自由基重排可能是该类天然产物真正的生物合成途径,从而丰富了我们对于萜类天然产物生物合成多样性的认识,而且也为自由基化学在天然产物合成中的广泛应用提供了新的指导思路。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657611625&idx=1&sn=b983eb3f3c2573fe85b0400cf795ce62&chksm=80f7c6b9b7804faf02ee02c75ae801dc629048684a4f31c3a6df199a3ec1f4c27541bf7befdf&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

铜催化下叔丁氧基自由基介导的烯烃酰基-氰基化反应及机理研究

Angew: NHC有机小分子催化实现烯烃的自由基酰基氟烷基化反应
JACS:首例自由基关环/开环串联聚合反应
JACS:镍催化的不对称自由基接力还原偶联反应
基于可见光促进的脱羧反应形成硅基自由基的新方法

手性Lewis酸催化不对称自由基-偶极交叉反应
“声东击西”!基于自由基Smiles重排的迁移还原交叉偶联反应
区域选择性自由基芳烃胺化反应合成邻苯二胺

谁能看见紫外光+绿光?
串联自由基环化/分子间偶联反应合成苯并呋喃衍生物