科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-11
5月24日,国际学术期刊Diabetes在线发表了中国科学院上海营养与健康研究所詹丽杏研究组的研究成果“Polarity Protein AF6 Controls Hepatic Glucose Homeostasis and Insulin Sensitivity by Modulating IRS1/AKT Insulin Pathway in an SHP2-dependent Manner”。该研究发现极性蛋白AF6(afadin and MLLT4)能够通过结合酪氨酸磷酸酶SHP2并且上调SHP2的活性抑制IRS1/AKT通路,并证明糖尿病小鼠肝脏中敲减AF6蛋白表达可以有效提高胰岛素敏感性并缓解胰岛素抵抗。
2型糖尿病(Type 2 diabetes, T2D)是一种慢性非传染性疾病。快速城市化、不健康的饮食和日益久坐的生活方式造成T2D的发病率不断升高。T2D表现为胰岛素抵抗和高血糖,但迄今为止其发病机制尚未完全阐明。肝脏是机体重要的代谢器官,在维持血糖稳态中发挥重要作用。肝脏糖代谢紊乱参与T2D的发生发展。深入了解肝脏糖代谢调控的分子机制不仅有助于揭示2型糖尿病发生发展的致病机理,而且能为该病的治疗提供新的靶标和思路。
极性蛋白AF6,又叫afadin或者MLLT4,是一种在进化上非常保守的F-actin结合蛋白,在胚胎和成人几乎所有的组织中都有表达。AF6在神经系统的发育、细胞极性的建立和维持、细胞的增殖和分化、肿瘤的发生发展等多种过程中都发挥着重要作用,但是AF6在肝脏中的功能,以及AF6是否参与细胞代谢都知之甚少。
博士研究生戴骋等人在研究员詹丽杏的指导下,探讨了极性蛋白AF6调控血糖稳态和胰岛素敏感性的新功能及作用机制。该研究发现高脂饮食诱导和db/db小鼠这两种糖尿病模型小鼠的肝脏中AF6的表达均显著提高。课题组进一步构建了AF6肝脏特异性敲除小鼠(AF6 LKO),证明AF6 LKO小鼠其血糖水平、葡萄糖耐受性、胰岛素敏感性均有显著改善。在肝原代细胞中发现,酪氨酸磷酸酶Src homology 2 domain-containing phosphatase 2(SHP2)是AF6的作用靶点,显示AF6结合SHP2并促进其磷酸酶活性是肝脏胰岛素信号通路的重要抑制信号。另一方面,SHP2的过表达有效阻断AF6敲除引起的胰岛素通路的活化以及小鼠的血糖表型,说明AF6能够通过SHP2来抑制IRS1/AKT信号通路。体内体外实验均证明了肝脏过表达AF6能够抑制胰岛素通路重要成员IRS1,以及AKT和GSK3β等下游信号,由此研究人员确认了AF6过负荷与肝脏胰岛素信号通路抑制相关分子机制。最后,在高脂饮食诱导的糖尿病小鼠和db/db小鼠肝脏中下调AF6能够显著改善高血糖和胰岛素抵抗的症状。该研究发现了肝脏中极性蛋白AF6调控糖代谢稳态和胰岛素敏感性的新功能和调控机制,为T2D的治疗提供了新思路,具有重要的理论意义和潜在的应用价值。
该研究得到营养与健康所研究员乐颖影和武汉大学教授刘勇的支持和帮助。该项目得到国家科技部、国家自然科学基金委以及中科院药物先导项目等的共同资助以及营养与健康所公共技术平台的支持。
文章链接
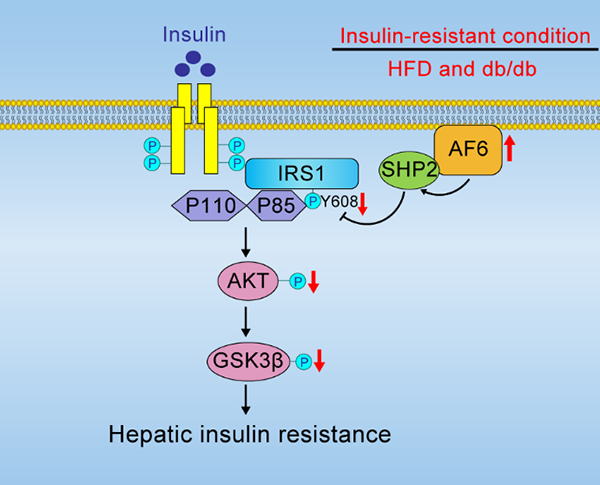
调控胰岛素敏感性的工作机制
来源:中国科学院
原文链接:http://www.cas.cn/syky/201906/t20190610_4694563.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
肝脏肿瘤

血液——肝脏再生的关键!

如何“制作”可移植肝脏?

肝脏受伤全过程
Nature | 肿瘤肝脏转移的分子机制
韩晓组揭示FoxO1乙酰化调节因子Ets1在肝脏糖异生中的调控功能和作用机制
功能性肝脏体积测定
专家点评JCI | 胖子能喝酒?棕色脂肪保护酒精性肝损伤

肝脏受伤全过程
科普丨爱肝日,维护肝脏,增进健康