科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-03-29
撰文 | Ruihua
肿瘤转移是绝大部分肿瘤患者死亡的最直接原因,是制约肿瘤治疗效果和预后的最大障碍。早在1889年,Paget就提出种子(肿瘤)-土壤(靶器官)学说,认为不同组织器官对同一肿瘤转移机会不均等【1】。2005年Kaplan等首次提出“肿瘤转移前微环境(pre-metastatic niche)”的概念,发现骨髓来源的VEGFR+VLA-4+造血祖细胞到达靶器官后,与靶器官内固有的成纤维细胞上的VLA-4配体fibronectin相互作用,形成肿瘤转移前微环境【2】。随后,一系列研究发现原发性肿瘤细胞通过释放可溶性因子、microRNA、囊泡等促进靶器官内形成转移前微环境,进而促进肿瘤转移。肝脏是代谢的枢纽,也是肿瘤转移的靶器官之一。肿瘤在发生肝脏转移前会在肝脏内形成转移前微环境,但是调控这一过程的机制目前仍不清楚。
近日,美国宾夕法尼亚大学的研究团队在Nature 杂志上发表了题为Hepatocytes direct the formation of a pro-metastatic niche in the liver的研究论文,报道了肿瘤肝脏转移的分子机制。

文章指出在胰腺肿瘤早期,肝脏内肝细胞的STAT3活化增强并产生更多分泌血清淀粉样蛋白A1和A2(serum amyloid A1 and A2, SAA),而STAT3的活化和SAA分泌依赖于原发肿瘤内非肿瘤细胞产生的IL-6。阻断IL-6–STAT3–SAA信号通路可阻止肿瘤转移前微环境的建立,进而抑制肿瘤的肝脏转移。
在本项研究工作中,研究人员通过胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)小鼠模型(LSL-KrasG12D/+;LSL-Trp53+R127H/+;Pdx1-cre (KPC))阐述肿瘤肝脏转移的机制。研究人员发现16周的KPC荷瘤小鼠的肝脏内骨髓细胞数量增加,伴随纤维连接蛋白和I 型胶原的蓄积,骨髓细胞积聚和细胞外基质沉积是肿瘤转移前微环境的重要特征,揭示肝脏内转移微环境的形成。研究人员进一步将KPC来源的PDAC细胞注射至对照和KPC小鼠内,发现KPC小鼠肝脏内形成显著的转移瘤,揭示KPC小鼠对肿瘤转移性肝脏定植更加敏感。
研究人员进一步通过RNAseq分析KPC和对照小鼠肝脏内基因表达情况,发现KPC小鼠肝脏SAA和S100家族基因表达均显著增强,IL-6–JAK–STAT3信号通路富集。免疫荧光染色验证发现,KPC小鼠肝脏内约80-90%的肝细胞中STAT3发生磷酸化,而对照组肝细胞内STAT3磷酸化低于2%。作者进而建立肝细胞特异性敲除Stat3的小鼠模型(Stat3flox/flox Alb-cre)并接种肿瘤,发现Stat3flox/flox Alb-cre小鼠肝脏内肿瘤转移前微环境和肿瘤的定植被阻断,表明肝细胞内STAT3的活化对肝脏内形成肿瘤转移前微环境起重要作用。
IL-6是肝细胞中STAT3信号通路的基础【3】。为验证IL-6对肝细胞内STAT3信号通路的影响,作者原位接种PDAC细胞至Il6−/−小鼠内,发现荷瘤Il6−/−小鼠肝细胞内STAT3活化降低,伴随着骨髓细胞聚集、细胞外基质蓄积的减少和SAA的表达的降低,但不影响原发肿瘤的生长、增殖和血管密度。且Il6−/−小鼠对肿瘤转移性肝脏定植的易感性也显著低于对照组。此外,通过IL-6R抗体阻断IL-6信号通路,也可显著抑制肝脏内形成肿瘤转移前微环境。值得注意的是,作者发现IL-6主要来源于原发肿瘤内的基质细胞而非肿瘤细胞本身。以上结果表明,来自于原发肿瘤内非肿瘤细胞产生的IL-6是肝细胞STAT3信号通路的重要调控者。
SAA蛋白是急性期反应物。与荷瘤小鼠体内循环SAA水平升高一致,PDAC病人体内循环SAA水平也升高,而且7例病人中有5例病人肝细胞内SAA和pSTAT3升高并伴随着肿瘤的肝脏转移。患者生存分析发现:体内循环SAA浓度越高,病人预后越差。此外,非小细胞肺癌和结直肠癌肝转移患者体内均检测到高水平循环SAA。而Saa−/−(Saa1−/− Saa2−/−双敲除)敲除小鼠可阻断肝脏内形成肿瘤转移前微环境但不影响原发肿瘤的生长,以上结果表明IL-6介导的肿瘤转移前微环境的形成依赖于SAA。
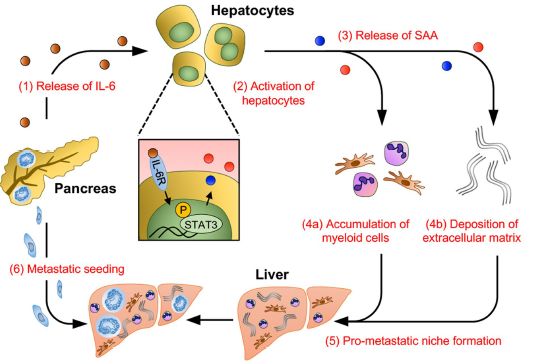
综合以上结果,这项工作发现原发肿瘤微环境内产生的IL-6激活肝细胞中STAT3,增加循环SAA的浓度,进而改变肝脏内免疫和基质微环境,建立肿瘤转移前微环境。此研究发现肝细胞内IL-6–STAT3–SAA信号调控网络是肿瘤转移前微环境形成的基础,靶向肝细胞内这一信号通路可能会预防肿瘤患者的肝脏转移。
原文链接:
https://doi.org/10.1038/s41586-019-1004-y
制版人:珂
参考文献
1. Paget S. The distribution of secondary growths in cancer of the breast. Cancer Metastasis Rev. 1989; 8(2):98-101.
2. Kaplan RN, Riba RD, Zacharoulis S, Bramley AH et al. VEGFR1-positive haematopoietic bone marrow progenitors initiate the pre-metastatic niche. Nature. 2005; 438(7069):820-7.
3. Schmidt-Arras, D, Rose-John, S. IL-6 pathway in the liver: From physiopathology to therapy. J Hepatol. 2016; 64(6):1403-15.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468104&idx=3&sn=fb22a1a9f983de4243fa3ecf0b7dd6df&chksm=84e2e03cb395692a1f5c9b7a38d3599a774ff5a0f1c7564a9c1a235e4c4403b325ded81b415c&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

柳叶刀:泽韦奇单抗抑制IL-6显著降低高危患者的动脉粥样硬化风险
肝脏肿瘤
肝细胞损伤
Cell:压力引起的焦虑会诱导炎症因子IL-6分泌,从而导致肥胖
全麻药在动物模型上通过IL-6通路影响乳腺癌转移
研究揭示肝细胞损伤再生之谜
哈佛大学医学院Kucherlapati教授访问中国抗癌协会


Nature:人肝细胞图谱问世!
棕色脂肪组织功能新发现:应激状态下通过分泌IL-6促进肝脏糖异生
Nature封面:癌症研究重大突破,揭开肿瘤转移之谜