科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-23
来源:BioArt
生命究竟从何时开始?很多人认为是精子与卵子结合的那一刻。然而,一个生命真正拥有个性的时刻,却是直到启动承继于父母亲的基因组转录才开始,这一刻被称为受精卵基因组激活(Zygotic Genome Activation, ZGA)期,有时也称为合子基因组激活期。ZGA在小鼠中发生于受精卵分裂成为两个细胞时(2细胞期),在人中则发生于4细胞至8细胞期。这一时期的主要特征是基因组大范围的转录激活,包括那些在成体细胞中可能有害的重复序列,如LINE1和ERV逆转座子。
ZGA对于胚胎的正常发育至关重要,但是迄今为止,控制这一过程的分子机制仍然迷雾重重,近期关于相关领域的工作多有报道,详见BioArt近期报道的相关工作(专家点评Nature Genetics | 张毅团队证明体内DUX并非小鼠胚胎基因组激活的关键因子;Dev Cell封面文章| 陈辉博士等揭示早期胚胎发育基因组激活的新机制)。
有意思的是,体外培养的胚胎干细胞中会有大约1%的细胞激活ERV逆转座子及部分ZGA时期特异表达基因的转录。当这些细胞被注射进胚胎后,既能分化成为胚胎细胞,也能分化成为胚外滋养层细胞(胎盘的一部分),而普通的胚胎干细胞只能分化成为胚胎细胞。因为这些特性,它们被赋予了很有感染力的名称,即“全能样干细胞”或“2细胞样干细胞”。由于与2细胞期胚胎共享部分转录程序,且比胚胎更容易培养和操作,2细胞样干细胞近年来被用作模型解析ZGA的分子机制。
2019年6月21日,北京大学分子医学研究所汪阳明研究组与胡新立以及清华大学那洁实验室合作在PLOS Biology在线发表最新研究成果DPPA2/4 and SUMO E3 ligase PIAS4 opposingly regulate zygotic transcriptional program。该研究发现PIAS4及SUMO2修饰是受精卵基因组激活以及体外全能样干细胞转化的屏障。

汪阳明实验室等通过研究胚胎干细胞向2细胞样干细胞转化的过程,鉴定得到了一个类泛素蛋白SUMO2 E3连接酶PIAS4,它可以强烈地抑制胚胎干细胞向2细胞样干细胞转化。相比于正常胚胎干细胞,PIAS4蛋白在2细胞样干细胞中几乎完全不表达,并且敲除PIAS4之后2细胞样干细胞的比例从约1%跃升至约40%。SUMO修饰在细胞内广泛存在,对蛋白的稳定性、细胞定位、结合其他蛋白或DNA的能力等起到调控作用。
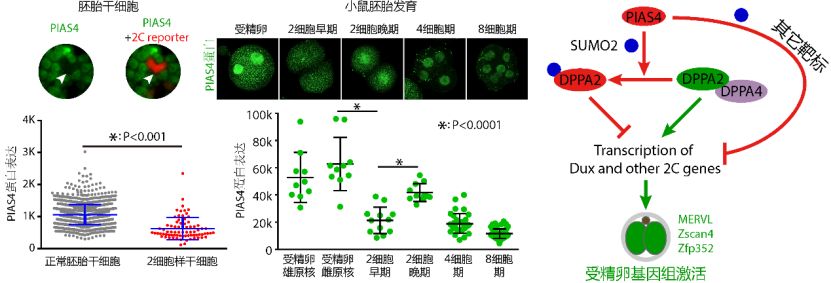
SUMO2 E3连接酶PIAS4及类泛素化修饰是受精卵基因组激活和全能样干细胞转化的屏障
为了解析PIAS4如何调控2细胞样干细胞的转化,他们对PIAS4催化的底物蛋白进行了鉴定。通过SUMO2免疫共沉淀实验鉴定出了92个潜在蛋白底物,接着利用CRISPRi技术对这些基因分别进行了敲低,发现多个因子参与调控2细胞样干细胞的转化。其中转录因子DPPA2可以促进2细胞样干细胞转化,但是PIAS4介导的SUMO2修饰使其由激活因子转变成了一个强烈的抑制因子;这也就解释了为什么PIAS4蛋白在2细胞样干细胞中几乎不表达,因为唯有如此才能释放DPPA2的激活功能。这些在体外培养体系做出的发现是否可以延伸到体内呢?他们发现PIAS4的表达在受精卵进入2细胞期时显著下调,而DPPA2的表达则显著上升,从表达水平上看符合体外培养体系的发现。他们进一步在受精卵中注射了PIAS4或者SUMO2-DPPA2融合蛋白,结果发现这些蛋白严重损害胚胎的发育,致使大量胚胎停滞在2细胞期。
由此他们得出结论,PIAS4以及由其催化生成的带有SUMO2修饰的DPPA2可能是ZGA激活过程中的屏障,移除这些屏障对于激活ZGA至关重要。本研究首次发现SUMO修饰在ZGA过程中有潜在重要功能。
据悉,北京大学分子医学研究所2012级博士生闫跃龙和前沿交叉学院2014级博士生张超为该论文共同第一作者,郝菁等为本论文做出重要贡献。北京大学分子医学研究所胡新立、王雪连协助执行小鼠胚胎RNA注射实验,清华大学医学院那洁实验室明佳协助执行小鼠胚胎嵌合实验。中国科学院陆发隆研究员与清华大学颉伟研究员为本论文提供了宝贵意见。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471606&idx=4&sn=15194435c527883eb8803e0c619fe120&chksm=84e21282b3959b94eece59e2b7394ab015c41539b982f2f49feeb9168ff0144dd55ad4ba9480&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
昆明动物所等在干细胞基因组稳定性调控机制研究中取得进展

研究揭示人类大脑进化的基因组调控机制

生物技术
第七期木薯生物技术与功能基因组学研讨会在海南海口成功举办
郑萍/孟飞龙合作揭示神经干细胞基因组稳定性调控因子Filia

北京大学吴华君-基因组3D结构调控胚胎干细胞分化
Prokka:快速原核基因组、宏基因组基因注释

昆明动物所阐明多能干细胞基因组稳态维持新机理
中科院等科学家合作在干细胞基因组稳定性调控机制研究中取得进展
北京基因组所揭示RNA甲基化调控基因剪接机制