科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-23
来源:BioArt
原标题:Nature亮点 | 中性粒细胞的黑暗面:释放组蛋白H4裂解动脉平滑肌细胞,造成动脉硬化斑块失稳
动脉粥样硬化由动脉血管壁发生慢性炎症导致,与脂质代谢不平衡和不良炎症反应相关【1】。近几十年,动脉粥样硬化引起的心血管疾病已成为人类死亡的主要原因,其中动脉粥样硬化斑块破裂是急性心血管事件的触发因素。动脉硬化斑块失稳急剧增加了斑块破裂的风险,而造成斑块失稳的主要原因是损伤区域平滑肌细胞(smooth muscle cells, SMC)的死亡【2】。目前,动脉粥样硬化损伤区域的平滑肌细胞的死亡原因和机制尚不清楚。
中性粒细胞是数量最多的天然免疫效应细胞,不仅在免疫防御过程中发挥作用,还会造成自身组织损伤。中性粒细胞杀伤靶细胞的方式分为两种:1.直接吞噬病原;2.释放NETs(neutrophil extracellular traps,中性粒细胞胞外陷阱,在防御病原入侵中起重要作用)。NETs是一种大型的,存在于细胞外的网状结构,它的骨架是染色质,支撑着组蛋白,颗粒蛋白(例如弹性蛋白酶(neutrophil elastase, NE)和髓过氧化物酶(myeloperoxidase, MPO)和一些胞质蛋白【3,4】。已有文献报道,MPO缺陷能抑制宿主动脉粥样硬化的发生【5】,说明NETs与动脉粥样硬化的发生相关,但机制并未阐明。
近期,来自德国慕尼黑大学心血管预防研究所的Oliver Soehnlein团队在Nature 发表了题为Externalized histone H4 orchestrates chronic inflammation by inducing lytic cell death的文章。文章报道了一种由胞外组蛋白H4介导的细胞裂解方式。中性粒细胞被招募到动脉粥样硬化损伤区域后,释放NETs并利用这种方式裂解SMC,造成硬化斑块的失稳。而阻断H4的裂解作用能够维持宿主动脉粥样硬化斑块的稳定性。

首先,作者发现损伤区域的中性粒细胞的数目和损伤区域面积正相关,与SMC细胞数量和斑块稳定性负相关。并且,使用药物干预和遗传突变的方法造成中性粒细胞减少,进一步导致了SMC含量和斑块稳定性的增加;相反,中性粒细胞增多则加剧了斑块的失稳。说明中心粒细胞在斑块失稳过程中起到重要作用。同时,损伤处中性粒细胞与SMC临近(图1),提示这两种细胞有直接的相互作用。那么趋化中性粒细胞与SMC临近的原因就是作者下一步要探究的内容。
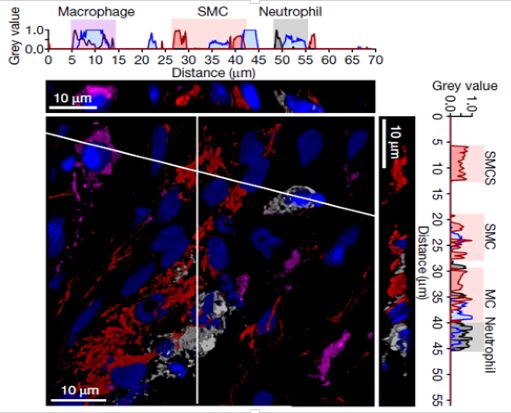
图1:损伤处免疫荧光显微照片(红色:SMC,灰色:中性粒细胞,洋红色:巨噬细胞)
作者发现受到血小板衍生生长因子(platelet-derived growth factor-BB, PDGF-BB)激活的SMC能够通过释放趋化因子CCL2和CCL7招募中性粒细胞。其中,CCL7能够诱发中性粒细胞NETs的释放。并且,阻断NETs的释放能够削弱中性粒细胞对SMC的杀伤(图2),表明NETs的释放是中性粒细胞杀伤SMC的主要方式。
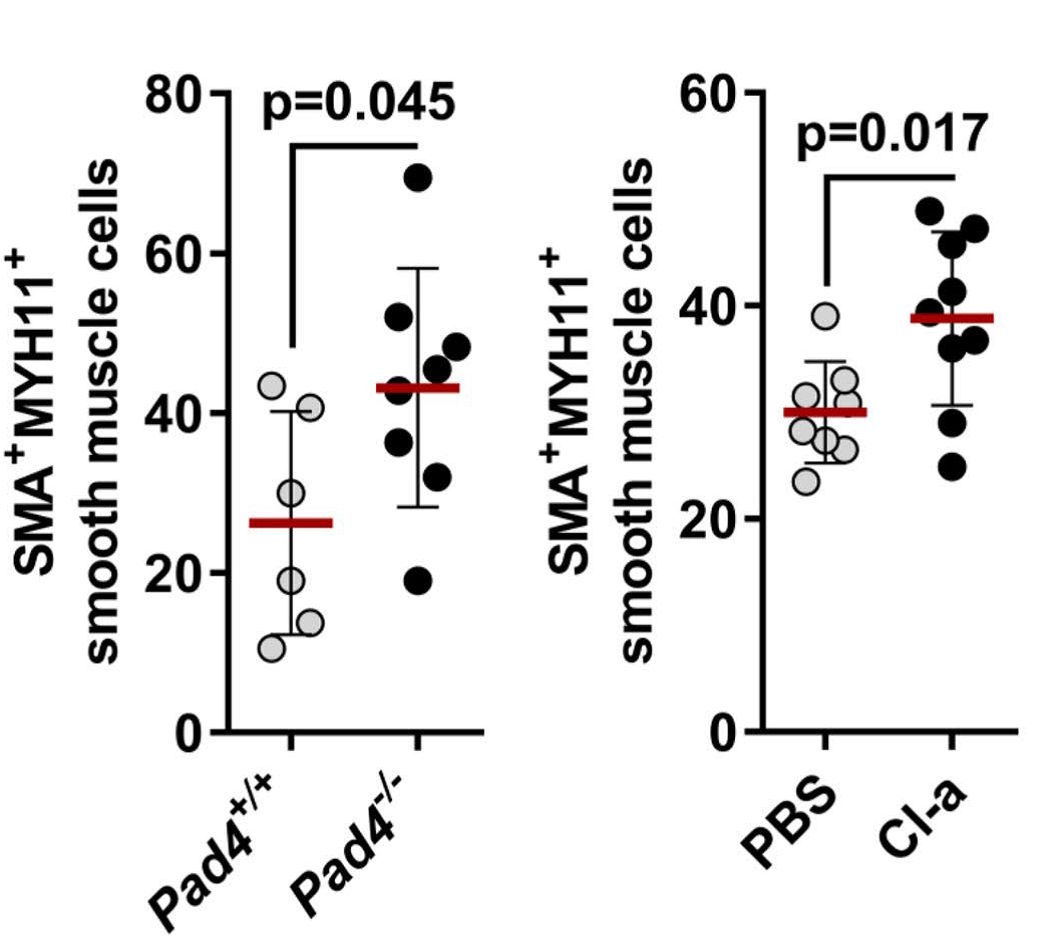
图2:敲除Pad4或使用PAD抑制剂Cl-amidine阻断NETs的释放对SMC存活的影响
作者进一步深入研究了NETs的杀伤机制。通过使用抗体阻断的方法,作者排除了NETs中颗粒蛋白的功能,鉴定出组蛋白H2A和H4发挥主要的杀伤作用。H2A发挥功能依赖于DNA的存在,而H4可独立实现对细胞的杀伤。重组的组蛋白H4可直接与细胞膜结合(图3),并在细胞膜上形成孔道,造成细胞的裂解。
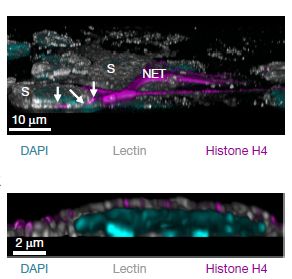
图3:组蛋白H4与细胞膜的结合
最后,作者筛选到多肽HIPe,它能够与组蛋白H4的N端相互作用,阻碍H4与细胞膜的结合。使用HIPe治疗发生动脉粥样硬化的小鼠,能够增加平滑肌细胞的数量和斑块的稳定性(下图),为临床治疗提供了新的靶点和策略。
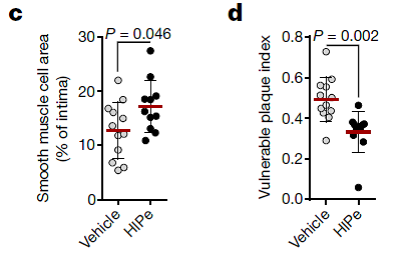
图4:多肽HIPe抑制动脉粥样硬化斑块的失稳
综上,作者鉴定了动脉粥样硬化损伤区域内SMC的死亡方式:趋化的中性粒细胞能够释放包含组蛋白H4的NETs,组蛋白H4结合SMC细胞膜表面并形成孔道,从而裂解SMC,加剧动脉硬化斑块失稳。进一步,阻断组蛋白H4的功能会保护SMC,并稳定硬化斑块,为临床治疗提供新的靶点。
本文的通讯作者为慕尼黑大学的Oliver Soehnlein教授,他获得欧洲心脏病学会颁发的2017年突出贡献奖,主要研究方向是髓系细胞在心血管炎性疾病中的功能。实验室成员Carlos Silvestre-Roig和Quinte Braster为共同第一作者。
参考文献
1. Weber C,Noels H. Atherosclerosis: currentpathogenesis and therapeutic options [J]. Nat Med, 2011. 17(11): 1410-1422
2. Silvestre-Roig C, de Winther MP, Weber C, etal. Atherosclerotic plaque destabilization: mechanisms, models, and therapeuticstrategies [J]. Circ Res, 2014. 114(1): 214-226
3. Jorch SK,Kubes P. An emerging role forneutrophil extracellular traps in noninfectious disease [J]. Nat Med, 2017.23(3): 279-287
4. Papayannopoulos V. Neutrophil extracellulartraps in immunity and disease [J]. Nat Rev Immunol, 2018. 18(2): 134-147
5. Milligan KL, Mann D, Rump A, et al. CompleteMyeloperoxidase Deficiency: Beware the "False-Positive"Dihydrorhodamine Oxidation [J]. J Pediatr, 2016. 176: 204-206
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471606&idx=6&sn=45bae524c136e4419b788622b46b312b&chksm=84e21282b3959b942de217e80a00b5e30356f8d90e8637d9f7648ec5499f375403fb33914497&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn