科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-26
来源:BioArt
cGAS(Cyclic GMP–AMP synthase,环鸟腺苷酸合成酶)是天然免疫领域的明星蛋白分子。2012年,美国西南医学中心的陈志坚课题组首先鉴定cGAS是细胞质DNA免疫识别通路(cGAS-STING通路)的DNA受体(DNA sensor)。cGAS识别并结合细胞质中异常存在的DNA(包括来自病原体的外源DNA和细胞自身损伤或病变而泄露的内源DNA)后被激活,催化产生第二信使分子2'3'-cGAMP,开启下游的STING介导的I型干扰素免疫反应信号通路。研究表明,cGAS-STING通路的失常与疾病密切相关,包括自身免疫性疾病与肿瘤免疫等。更重要的是,cGAS作为一种酶,其酶活口袋有很大的潜力被药物小分子特异性的结合,cGAS因此具有较高的成药性,是治疗相关疾病的理想药物靶点。
虽然鼠源cGAS-DNA复合物结构模型阐明了cGAS的催化机制——DNA与cGAS结合后会诱导 cGAS的活性口袋从无活性的关闭构象转变为具有活性的开放构象【1】。但是,cGAS作为DNA受体,它对胞质DNA的识别具有很多有趣的性质尚不能被很好的解释。其中主要包括两方面,1)在体外,鼠cGAS与17-bp长度的DNA就可以形成稳定复合物,并可以诱导酶活口袋的构象变化催化反应,但是在体内,长度大于45-bp的DNA分子才可以高效激活鼠源细胞cGAS介导的免疫反应,而对于人源cGAS,需要长度大于100-bp的DNA分子激活细胞免疫反应。因此cGAS的激活具有DNA长度的依赖性,并且人cGAS与鼠cGAS对DNA长度的依赖性质不同;2)cGAS-DNA的酶活性也具有浓度的依赖性。即高于某个浓度阈值的时候,cGAS-DNA的酶活在一定范围内会随着浓度的提高而接近指数级的增长。cGAS对于DNA分子长度与浓度的依赖性具有重要的生理意义,一方面保证了对于危险信号的响应效率,另一个方面减少了背景噪音(DNA碎片或低浓度DNA)的干扰,提高了免疫监视的控制能力。因此,阐明cGAS识别DNA的独特性质的分子机理仍是亟待解决的重要科学问题。围绕此科学问题,很多研究组都做出了重要贡献,其中比较有代表性的几个进展是:
1、2017年,德国慕尼黑大学Hopfner研究组在NATURE报道了2个鼠cGAS的二聚体与2条39-bp DNA分子的复合物的晶体结构,并提出了不同的cGAS二聚体可以协同结合在相同的DNA分子上的梯子(Ladder)模型,指出长链的DNA可以逐步结合更多的cGAS二聚体而组成更稳定的oligomer结构而增强酶活性【2】。
2、2018年,陈志坚研究组在SCIENCE上报道了cGAS-DNA的相分离(phase separation)现象【3】,发现cGAS的N端不规则结构与和C端酶活结构域可以分别与DNA分子进行动态多价相互作用(multivalent interactions)而相分离,液滴可以作为cGAS-DNA的微反应器而极大的提高酶活反应效率,而长链DNA分子具有更多的多价结合位点可以结合cGAS,因此cGAS-DNA的相分离也是DNA长度与浓度依赖性的,完美的解释了cGAS识别DNA的独特性质。
3、2018年,哈佛医学院Kranzusch实验室通过筛选一系列人和鼠的cGAS嵌合体,发现将鼠cGAS中的两个氨基酸引入到人cGAS的相应位点(K187N/L195R),可以显著增强cGAS的活性,并在CELL上首先报道了此嵌合体cGAS与17-bp DNA的复合物结构【4】,指出与鼠cGAS相比,人源cGAS的在DNA结合面上的这两个loss-of-function的氨基酸点突变,减弱了cGAS对短链DNA的亲和力从而提高了cGAS识别DNA的长度阈值。
近日,来自纽约斯隆凯瑟琳癌症研究所的Dinshaw Patel课题组(谢伟博士为第一作者与共同通讯作者)在PNAS上发表了题为 Human cGAS catalytic domain has an additional DNA-binding interface that enhances enzymatic activity and liquid-phase condensation 的文章,通过解析人类cGAS-DNA复合物的结构揭示了人源cGAS具有一个新的DNA结合面,进一步从分子水平解释了人源cGAS识别DNA的独特性质。

为了获得人cGAS-DNA的稳定复合物,研究人员设计了一个人源cGAS融合蛋白,通过用人体SRY(Y染色体性别决定基因,可以高亲和力的结合特殊序列的DNA)结构域替换人源cGAS的N端不规则结构域而使SRY.cGAS融合蛋白可以稳定的结合在DNA分子的特定位置,并由此解析了人源SRY.cGAS-DNA复合物的晶体结构(图1),其中cGAS为野生型,因此可以提供更准确的cGAS-DNA相互作用的结构信息。

通过对人源SRY.cGAS-DNA复合物的结构分析,研究人员意外发现,除了之前报道过的cGAS-DNA之间的结合方式,人的cGAS具有一个未被发现的DNA结合面,此结合面完全由带正电的精氨酸或者赖氨酸组成,通过电荷相互作用非序列特异性的与DNA分子结合。通过对已发表的鼠源与猪源cGAS-DNA复合物的结构与序列分析,表明新的DNA结合面从鼠到人的进化过程中不断被增强,由一系列的gain-of-function的氨基酸突变组成。生化实验表明,新发现的DNA结合面虽然与cGAS的活性口袋的构象变化无关,但是将此DNA结合面破坏后,却会显著降低人体cGAS的酶活性。与肿瘤相关的cGAS的2个重要氨基酸突变位点也位于这个DNA结合面上,显示出其对于cGAS正常功能的重要性。
新的DNA结合面上的人cGAS突变体显著减弱了对DNA的结合与浓缩(condensation)能力,同时也减弱了cGAS-DNA的相分离。有趣的是,当研究人员人为的将鼠的cGAS的相应位置突变为人源cGAS的DNA结合面时,鼠的cGAS的DNA浓缩能力与相分离能力获得了显著增强,这表明新的DNA结合面是人cGAS与鼠cGAS具有不同DNA识别性质的重要原因,新的DNA结合面使人源cGAS在进化中获得了更好的DNA浓缩与相分离能力。
基于新鉴定的DNA结合面,研究人员新提出了cGAS与DNA相互作用的束状(Cluster)模型(图2):cGAS二聚体通过传统的DNA结合面协同结合在长链DNA上后,人cGAS在进化中获得的新的DNA结合面的存在使线状的cGAS-DNA梯子(Ladder)模型可以向三维方向扩展为非线性的束状(Cluster)模型, cGAS与 DNA的动态多价相互作用为相分离提供了分子基础,从而提高了cGAS对于胞质DNA免疫监视能力的阈值控制能力。束状模型很好的调和了cGAS-DNA梯子模型与相分离模型,加深了人们对于cGAS识别DNA的机制的理解。
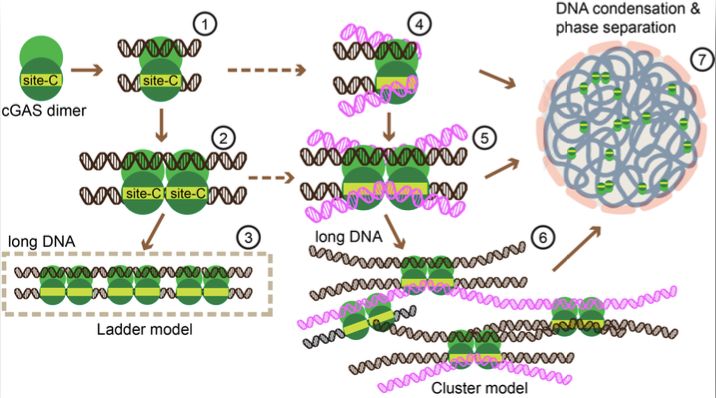
研究人员推测,正是因为新的DNA结合面的存在,提高了人cGAS与 DNA结合的不均一性,使人cGAS-DNA的复合物晶体难以获得。据此,研究人员设计了一个人cGAS的突变体来破坏新的DNA结合面,并获得了高分辨率的人cGAS(突变体)-DNA复合物结构,这个复合物结构的解析策略可以被用作小分子药物的结构设计与筛选,也进一步验证了新提出的人cGAS-DNA复合物束状模型的正确性。
原文链接:
www.pnas.org/cgi/doi/10.1073/pnas.1905013116
制版人:珂
参考文献
1. P. Gao et al., Cyclic [G(2′,5′)pA(3′,5′)p] is the metazoan second messenger produced by DNA-activated cyclic GMP-AMP synthase. Cell 153, 1094–1107 (2013).
2. L. Andreeva et al., cGAS senses long and HMGB/TFAM-bound U-turn DNA by forming protein-DNA ladders. Nature 549, 394–398 (2017).
3. M. Du, Z. J. Chen, DNA-induced liquid phase condensation of cGAS activates innate immune signaling. Science 361, 704–709 (2018).
4. W. Zhou et al., Structure of the human cGAS-DNA complex reveals enhanced control of immune surveillance. Cell 174, 300–311.e11 (2018).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471708&idx=2&sn=05bff007231c266d480184c0273cc721&chksm=84e21228b3959b3ec66ecccf4faded37886a7dcec154a1be8fb54fa9d6690bc5b5399460a325&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
演化:“最奇怪动物”身份揭秘
寻找环境古DNA
DNA科普漫画(一)——致DNA的美丽邂逅



DNA王朝内幕

Nature:DNA错配如何影响蛋白质-DNA结合?
DNA多聚酶
DNA-PK激活STING非依赖的DNA识别通路

夫妻相真的存在,研究发现夫妻DNA相似度高过陌生人
古DNA研究概览

NBT:DNA数据储存技术的新突破——复合DNA“字母”的应用