来源:X一MOL资讯
苯炔、环炔以及环状联烯等结构具有非常大的环张力。在过去的一个世纪里,化学家对这些结构的研究兴趣持续高涨。1902年,Stoermer和Kahlert提出了颇具争议的2,3-苯并呋喃炔(1)的结构。50年后,Roberts和Wittig分别证实了苯炔(2)中间体的结构,这一发现大大促进了相关领域的发展。随后,环己炔(3)和1,2-环己二烯(4)的结构相继被确定。由于中间体2-4具有非常大的环张力(30-50 kcal/mol),因此它们具有非常高的反应活性和非常短的寿命(图1a)。如今,这些中间体(特别是苯炔)已被用于多种反应中(如环加成、亲核加成),在合成杂环化合物、药物分子、配体(如XPhos)、天然产物、农用化学品以及有机材料等领域发挥着非常重要的作用。尽管如此,这些高张力中间体参与的不对称催化反应却非常罕见,迄今为止,仅有两例报道:第一例是钯催化的苯炔不对称[2+2+2]环加成反应(Adv. Synth. Catal., 2006, 348, 2466–2474; J. Am. Chem. Soc., 2020, 142, 10025–10033);第二例是电催化原位产生的苯炔与手性烯胺的不对称α-芳基化反应(Angew. Chem. Int. Ed., 2020, 59, 14347-14351)。虽然这些例子大大促进了苯炔研究领域的发展,但是基于环状联烯的不对称催化反应却仍未报道。
在环状联烯的不对称研究领域中,Balci 和Jones做出了非常大的贡献(J. Am. Chem. Soc., 1980, 102, 7607–7608)。他们发现当用手性纯的环状联烯前体5产生相应手性纯的联烯6时,中间体6会快速消旋化,因此只能得到消旋的加成产物7,这一结果证实了手性环状联烯的消旋速率远远快于捕捉反应的速率(图1b)。在此基础上,美国加州大学洛杉矶分校的Neil K. Garg教授和K. N. Houk教授课题组设想,既然联烯的对映异构体可以快速相互转化,那么能否使用合适的催化剂通过动态动力学拆分(DKR)过程来合成单一的手性产物?(图1c)。近日,他们在Nature 上首次报道了环状联烯参与的不对称镍催化反应(图1d)。具体而言,外消旋的三氟甲硅烷基环状联烯前体8可以在氟源的作用下转化为环内联烯9和ent-9的外消旋混合物,然后在镍催化的作用下,通过动态动力学拆分得到手性纯的产物11。
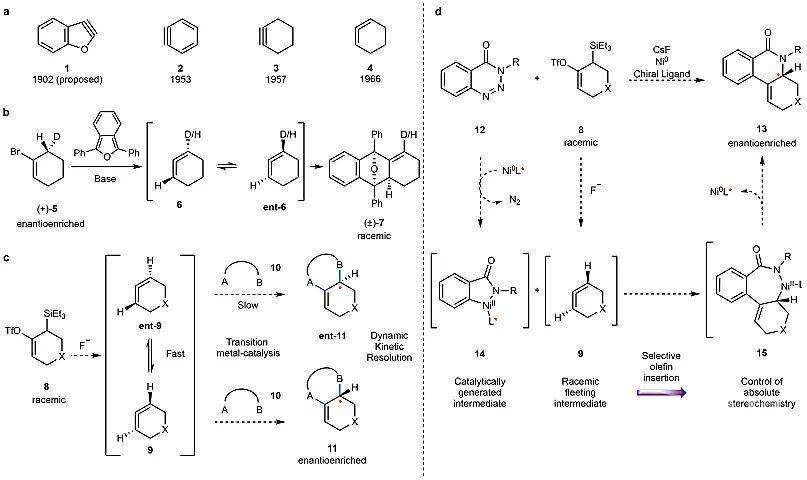
图1. 研究背景及该工作。图片来源:Nature根据作者的设想,环状联烯参与的不对称金属催化反应需要具备以下几个条件:(1)催化体系要与产生环状联烯中间体的条件兼容;(2)金属有机中间体的产生速率要足够快;(3)反应条件要足够温和,使得背景反应和不对称反应的速率差异足够大。在此基础上,通过文献调研,作者发现1,2,3-苯并三嗪-4-酮12与环状联烯前体8反应生成三环产物13或许符合这些条件(图1d)。但是,这一过程至少存在以下几个挑战。首先,联烯中间体9和金属中间体14在反应体系中的浓度都非常低,如何让两个低浓度的中间体在体系内有效地进行反应将会是第一个难题。其次,为了获得一个理想的动态动力学反应效果,如何使中间体9的消旋速率明显快于烯烃中间体的插入速率是另外一个难题。最后,如何使金属中间体14高选择性地与联烯的一个对映异构体反应将会是第三个难题。
为此,作者首先尝试发展目标反应的外消旋化(图2)。经过一系列优化,作者发现在Ni(cod)
2为预催化剂、1,1'-双(二苯基膦基)二茂铁(DPPF)为配体、氟化铯为氟源、乙腈为溶剂的条件下,1,2,3-苯并三嗪-4-酮16与环状联烯前体17能够顺利地进行反应,生成相应的环化产物,并具有一定的普适性。对于1,2,3-苯并三嗪-4-酮类底物而言,不仅可以耐受氮原子上的各种保护基(如p-MePh、p-FPh、甲基或者苄基,21-24),还可以耐受各种芳环(如富电子芳环25、缺电子芳环26),甚至杂环化合物(27-28)也能实现这一转化。对于联烯类前体底物而言,氧杂环烯(29)、氮杂环烯(30-31)以及七元环碳烯(32)都能兼容该反应,以中等至较好的收率(64-99%)得到目标产物。此外,当杂环联烯的双键上带有取代基时,也能以中等至较好的收率(60-89%)得到目标关环产物(33-35)。需要指出的是,目标产物33是一对位置异构体(33a:33b = 3.8:1)的混合物,而34和35则为单一的位置异构体(图2)。这些例子表明虽然环状联烯的反应活性高,但是它们仍能有效地参与过渡金属催化的有机反应。
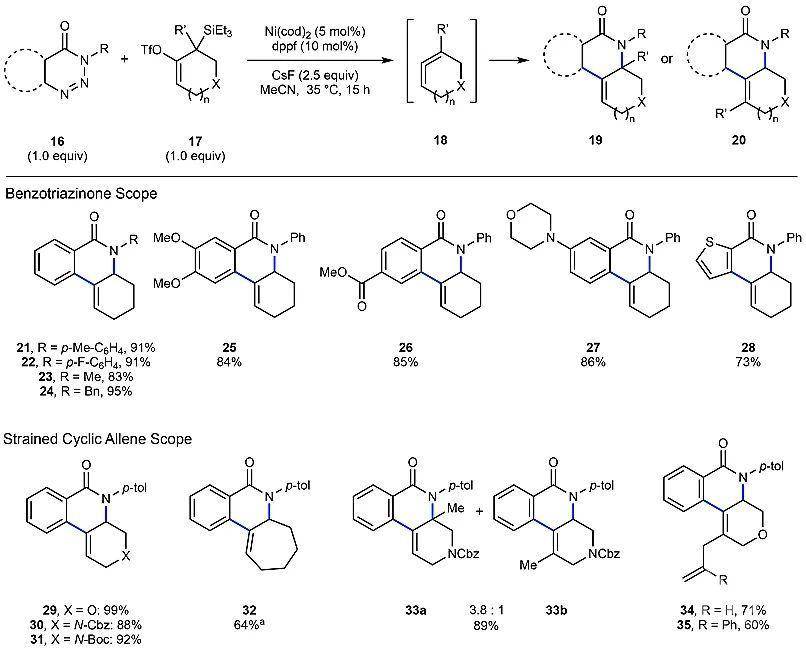
图2. 消旋环化反应的底物范围。图片来源:Nature接下来,作者把注意力转向了不对称合成。消旋反应和不对称合成的区别在于手性配体。通过利用36和37为反应原料,Ni(cod)
2 (5 mol%)为金属催化剂,CsF为产生联烯的促进剂,乙腈为反应溶剂,作者评估了不同手性配体的反应活性。结果显示在筛选的所有配体中(L1-L5,图3a),L5(Josiphos)效果最好(90% ee),尽管收率较低(37%)。进一步的研究表明降低配体的量(10 mol%→5 mol%)能够显著地提高反应的收率(70%)。最终,在三当量TBAI为添加剂的条件下于3 ℃反应24 h,以85%的收率、94%的ee值得到目标产物(–)-21。需要指出的是,TBAI在该反应中的作用是提高氟离子的溶解度,进而提高联烯的生成速率。
在最优条件下,作者评估了不对称反应的底物范围(图3b)。不论氮上带有烷基保护基还是芳基保护基,都能以较好的收率(71-81%)和优异的对映选择性(81-94% ee)得到目标产物((–)-38-(–)-39、(–)-22-(–)-24)。此外,含氧或含氮杂环的联烯前体也能实现这一转化,得到所需的三环产物((–)-29-(–)-31、(–)-40)。
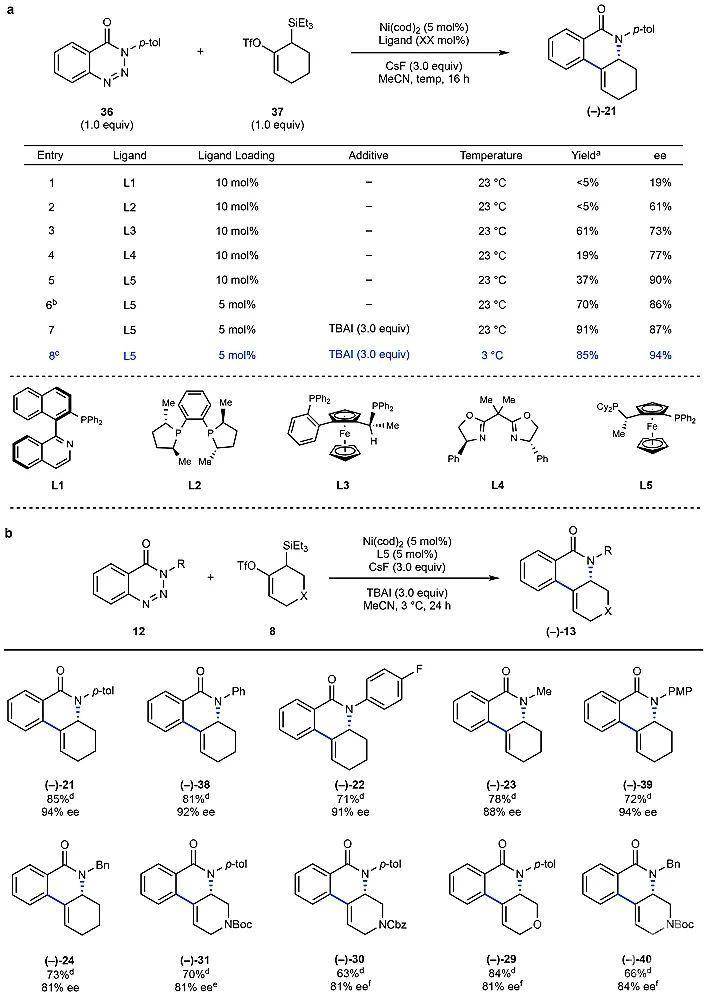
图3. 不对称环化反应的优化及底物范围。图片来源:Nature为了进一步研究反应机理,作者进行了密度泛函理论计算(DFT),并对比了各种可能的反应过程(图4)。由于产生联烯的过程非常迅速,因此作者推测该反应的决速步可能是金属中间体对联烯的插入过程。通过利用41为模拟金属中间体,4为联烯中间体,作者分别计算了联烯4的两个对映异构体与41进行插入反应的活化能(图4a)。结果表明,4与41反应的活化能(TS-1,∆G
‡ = 7.5 kcal/mol))比ent-4与41反应的活化能(TS-1a,∆G
‡ = 14.9 kcal/mol))低7.4 kcal/mol,这意味着如果从中间体42直接进行还原消除,那么最终产物(–)-21的ee值应该高于 99%,但实验结果仅为94%。此外,从中间体42直接进行还原消除得到了与实验结果相反的的产物(+)-21。这些矛盾之处表明目标产物并不是由中间体42直接进行还原消除而来。事实上,计算结果表明42直接进行还原消除生成(+)-21的活化能为37.1 kcal/mol(图4c),这证实了42不可能直接进行还原消除得到目标产物。
随后,作者提出了一个42到44的反应机理。具体而言,在生成η
3-烯丙基镍络合物44后,他们对这两个可能的过程进行了计算,得到了两个不同的过渡态Ts-3(12.9 kcal/mol,生成(–)-21)和Ts-3a(14.4 kcal/mol,生成(+)-21)。这两个步骤的活化能相差1.5 kcal/mol,预测(–)-21的ee值为87%,与实验值(94% ee)很接近,从而证实了由42生成21经过中间体44的合理性(图4c)。总的来说,DFT得到了以下几个重要结论:(1)在金属插入联烯的步骤中,催化剂的手性环境可以区分联烯的两个对映异构体;(2)在得到插入产物后,反应并没有直接进行还原消除,而是产生了一个η
3-烯丙基镍络合物;(3)随后氮原子与联烯的一号碳原子选择性成键,最终生成目标产物(–)-21(图4)。
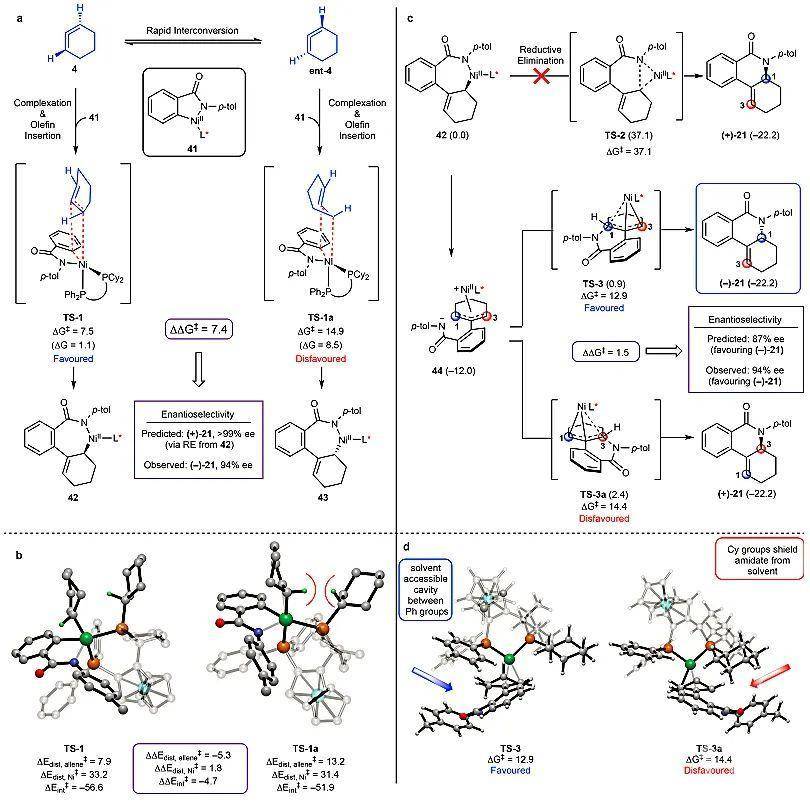
图4. 不对称反应机理的计算研究。图片来源:Nature
小结在这篇文章中,Garg课题组首次报道了环状联烯参与的不对称镍催化反应。机理研究表明该反应在联烯插入后,并不是直接进行还原消除得到目标产物,而是经过了一个η3-配位的反应中间体。
在笔者眼中,该反应仅能合成某种特定类型的产物,并不具有普适性,但是考虑到环状联烯的高活性及发展不对称催化反应的挑战,该工作在有机合成领域中仍将具有非常重要的意义。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657659732&idx=1&sn=af537046d807204502baa2a6ecc98bd6&chksm=80f88284b78f0b9209bd4f0ea424081cf72e7a720e07e500ec0b2007c78470b71e431af0b068&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn