科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-23
来源:BioArt
原标题:PLoS Biology:王强团队揭示胚胎左右不对称发育过程中细胞周期调控纤毛形成的重要机制
动物胚胎如何由一个均一的卵裂球发育为具有头尾、背腹和左右等不对称特征的胚胎,是发育生物学中一个重要的研究领域。为纪念创刊125周年,Science 杂志于2005年7月提出了125个重要的科学问题。上述胚胎不对称性建立的机制,即属于其中的科学问题之一。
左右不对称(left-right asymmetry)在自然界中很常见的。例如,招潮蟹左右分别有一个大的和一个小的蟹钳,而比目鱼总是身体一侧躺在海底。大多数脊椎动物虽然从外表看上去是左右对称的,但心脏在发育过程中是不对称环化的,并且最终定位在胸腔左侧;左右肺也是由不同数目的肺叶组成的。在腹腔中,胃和胰腺位于左侧,肝脏位于右侧,而且肠道也是不对称卷曲的(图1)【1】。有意思的是,我们人类的脑部也表现出从结构和功能上的左右不对称性。在胚胎发育过程中,左右不对称缺陷有可能带来严重的后果。内脏异位 (Heterotaxy) 是一类以随机的内脏左右分布为特征的遗传疾病,发病率在1:10000作用。先天性心脏病的发病几率在内脏异位的病人中大大增加,尤其是大动脉的移位及室间隔的缺陷尤为常见【2,3】。
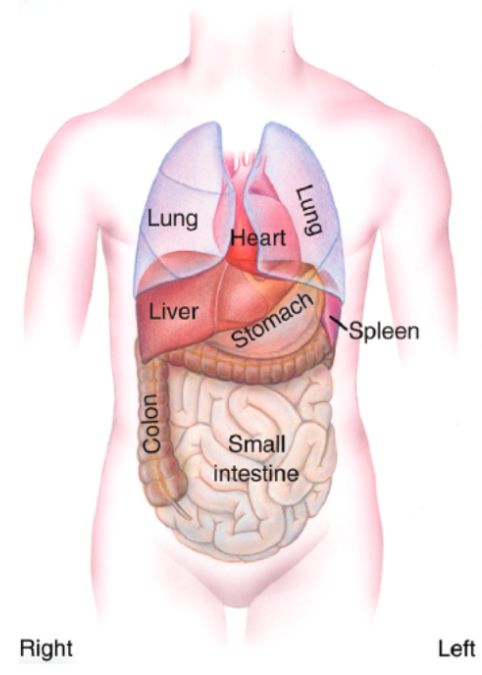
图1. 人体内部的左右不对称性。
目前,对于胚胎左右不对称发育的机制已经有了初步的了解。起初,胚胎沿体轴中线进行左右对称性发育。在体节期,脊索最末端出现了一个小的凹陷。组成这个凹陷的细胞均具有纤毛。这些纤毛有规律的摆动,使得凹陷内部的液体沿逆时针方向一圈又一圈的流动。如果液流停滞或变慢,将导致胚胎内脏器官的位置随机性分布。因此,胚胎的这种凹陷结构被称为左右组织者(left-right organizer)。在斑马鱼中,左右组织者是Kupffer’s vesicle, 简称KV【4-6】。KV起源于背部先驱者细胞(dorsal forerunner cell)。背部先驱者细胞是胚胎一群特化的细胞,在原肠胚期经历剧烈的增殖,然后分化为具有纤毛的KV细胞。背部先驱者细胞增殖出现问题,经常伴随着KV细胞纤毛生成缺陷【7,8】。但目前对细胞周期进程与纤毛形成之间的联系却知之甚少。
2019年8月20日,中国科学院动物研究所膜生物学国家重点实验室王强研究员团队在PLoS Biology在线发表了题目为Chemokine signaling links cell cycle progression and cilia formation for left-right symmetry breaking的研究论文,揭示了在胚胎左右不对称发育过程中,细胞周期调控纤毛形成的重要分子机制。

王强研究员团队发现趋化因子受体Cxcr4a表达于斑马鱼背部先驱者细胞和KV细胞中。cxcr4a突变体的心脏和肝脏呈现明显的随机分布,表明其左右不对称性发育出现问题。有趣的是,其配体Cxcl12a的突变体也具有类似的表型。随后的研究揭示,cxcr4a突变体KV变小,细胞纤毛变短,并且KV内的液流停滞(图2)。作者进一步确定了KV变小的原因,发现Cxcr4a通过调控ERK1/2磷酸化,促进细胞周期蛋白CyclinD1表达,加速背部先驱者细胞从G1期向S期转换,在细胞增殖调控中发挥着关键作用。
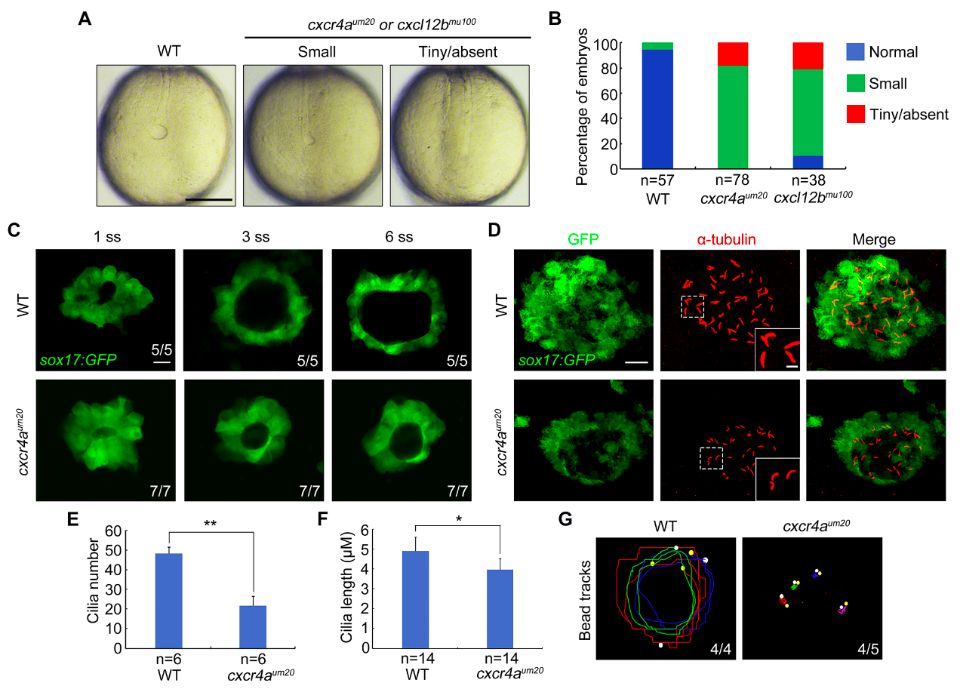
图2. Cxcr4a突变体KV较小,细胞纤毛变短,KV液流停滞。
有意思的是,作者发现在cxcr4a突变体中补充CyclinD1,不但细胞增殖得以恢复,细胞纤毛也可以正常形成,挽救了胚胎的左右不对称发育缺陷。接下来,作者通过生化分析发现,Cyclin D1-CDK4/6复合体中的CDK4可以结合并磷酸化纤毛形成的关键转录因子Foxj1a,并确定了磷酸化位点为进化上保守的T102。CDK4对于Foxj1a蛋白T102的磷酸化,抑制了蛋白酶体对Foxj1a的降解,是KV细胞纤毛形成的必要条件。尤其值得注意的是,Foxj1a的降解与其泛素化修饰无关。Foxj1a通过直接与斑马鱼蛋白酶体19S调节亚基Psmd4b结合,进入蛋白酶体降解途径。CDK4磷酸化Foxj1a蛋白T102位点,阻止了Foxj1a与Psmd4b相互作用,从而使得Foxj1a脱离了被降解的命运,促进细胞纤毛形成。
综上所述,趋化因子Cxcl12b/Cxcr4a信号通路通过激活ERK1/2活性,调控下游基因Cyclin D1表达。Cyclin D1-CDK4/6复合体一方面促进细胞增殖,另一方面磷酸化转录因子Foxj1a,增强其蛋白稳定性,促进细胞纤毛生成(图3)。该研究不仅揭示了胚胎左右不对称发育中细胞周期进程与纤毛形成之间关联的分子机制,而且提示在胚胎的原肠期,背部先驱者细胞的增殖不仅为KV结构的建立提供了足够数目的细胞,更是为下一阶段KV细胞纤毛生成储存了足够多的Foxj1a蛋白。
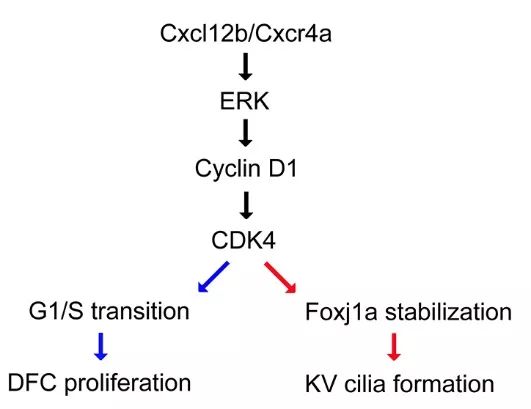
图3 . Cxcl12b/Cxcr4a信号通路调节细胞增殖及纤毛形成。
据悉,中国科学技术大学与中科院动物所联合培养的博士研究生刘静雯为论文第一作者,西南大学的朱成科副教授为共同第一作者。通讯作者为中国科学院动物研究所王强研究员和成都医学院黄四洲副研究员。
原文链接:
https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3000203
王强博士,中国科学院动物研究所膜生物学国家重点实验室研究员,主要以“细胞信号转导与胚胎早期发育”为中心科学问题,以斑马鱼为主要模式动物,结合多种人及小鼠细胞系,深入探讨重要信号通路在胚胎早期发育和组织器官形成中的功能和调控机制,以通讯作者身份在Developmental Cell、Nature Communications、Cell Research、PLoS Biology、PLoS Genetics、Journal of Neuroscience等国际主流杂志发表多篇研究论文,担任《中国实验动物学报》及《中国比较医学杂志》副主编,中国细胞生物学学会发育生物学分会副会长,北京生物化学与分子生物学会青年委员会副主任,中国动物学会斑马鱼分会理事等学术职务。
主要参考文献
1. Grimes DT, Burdine RD, Left-Right Patterning: Breaking Symmetry to Asymmetric Morphogenesis. Trends in genetics, 2017. 33(9): p. 616-28.
2. Kennedy, M.P., et al., Congenital heart disease and other heterotaxic defects in a large cohort of patients with primary ciliary dyskinesia. Circulation, 2007. 115(22): p. 2814-21.
3. Shiraishi, I. and H. Ichikawa, Human heterotaxy syndrome - from molecular genetics to clinical features, management, and prognosis. Circ J, 2012. 76(9): p. 2066-75.
4. Essner, J.J., et al., Kupffer's vesicle is a ciliated organ of asymmetry in the zebrafish embryo that initiates left-right development of the brain, heart and gut. Development, 2005. 132(6): p. 1247-60.
5. Matsui, T. and Y. Bessho, Left-right asymmetry in zebrafish. Cell Mol Life Sci, 2012. 69(18): p. 3069-77.
6. Roussigne, M., P. Blader, and S.W. Wilson, Breaking symmetry: the zebrafish as a model for understanding left-right asymmetry in the developing brain. Dev Neurobiol, 2012. 72(3): p. 269-81.
7. Gokey JJ, Dasgupta A, Amack JD, The V-ATPase accessory protein Atp6ap1b mediates dorsal forerunner cell proliferation and left-right asymmetry in zebrafish. Developmental biology, 2015. 407(1): p. 115-30.
8. Zhang M, Zhang J, Lin SC, Meng A, beta-Catenin 1 and beta-catenin 2 play similar and distinct roles in left-right asymmetric development of zebrafish embryos. Development, 2012. 139(11): p. 2009-19.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474300&idx=5&sn=a8735f559343bd6455cd31ddec584b8b&chksm=84e21808b395911e86e49326fae560b68c06a239045b07e2198cf208ab2b6847e7d2f084b2db&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
层状氮化物MNCl (M: Hf, Zr)中电场诱导的稳态超导电性

研究揭示胚胎左右不对称发育过程中细胞周期调控纤毛形成机制
细胞生物学: 模型原始细胞也许可预测原始细胞周期
【大师讲堂】细胞周期与癌症发生有着怎样的联系?
Cell Reports:破坏细胞周期检验点治疗肿瘤的新思路
关于举办“环境友好的农林害虫生态调控与生物防治技术高级研修班”通知
新研究鉴定出300种调节细胞周期的蛋白
Nature亮点 | 发现参与细胞周期调控的新关键因子

【学术前沿】NaturePLoS Biology | 王强团队揭示胚胎左右不对称发育过程中细胞周期调控纤毛形成的重要机制
微生物所发现流感病毒调控宿主细胞周期的新机制