科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-03
来源:BioArt
线粒体通过氧化磷酸化形成ATP为细胞提供能量,线粒体能量的产生与细胞对能量的需求是相适应的。然而,线粒体产能效率如何适应细胞内ATP水平的具体机制尚不清楚。ATP敏感性钾通道(ATP-sensitive potassium channel,KATP)作为细胞内代谢的感受器,能够在能量充足时引起细胞兴奋【1-2】。线粒体中也存在ATP敏感性钾通道(mitoKATP),受线粒体膜负电位(ΔΨm)驱动吸收K+,并且受到生理水平ATP的抑制。药物二氮嗪(diazoxide)可激活mitoKATP保护心脏免受局部缺血再灌注损伤【3-4】。因此,mitoKATP很有可能就是连接细胞内能量水平与线粒体产能的关键复合物。然而,mitoKATP分子的鉴定与其药理学特征却不甚清楚【5】。
2019年8月22日,来自意大利帕多瓦大学的Diego De Stefani和Rosario Rizzuto团队在Nature上发表题为Identification of an ATP-sensitive potassium channelin mitochondria的文章,首次鉴定了存在于人类和小鼠所有组织的线粒体ATP敏感性钾通道蛋白复合物,证实其通过调节线粒体体积和功能响应了胞内能量状态,从而在线粒体生理与疾病过程中起到关键作用。

为了鉴定线粒体ATP敏感性钾通道复合物,作者分析了一组未知功能的线粒体蛋白,找到了由CCDC51(命名为MITOK)编码的蛋白作为候选。这个基因在脊椎动物中保守编码了一个45kDa的蛋白,具有N末端线粒体定位序列以及一个卷曲螺旋和两个跨膜结构域。人类中该基因有两个亚型,亚型1具有全长但无线粒体定位序列,亚型2是缺少109个氨基酸的剪接变体却含有线粒体定位序列。有数据表明MITOK表达于人类和小鼠的所有组织。
随后作者利用免疫荧光、亚细胞分离等方法证实其定位于线粒体内膜。过表达MITOK后发现,在形态学上,导致了线粒体片段化以及膨胀;在功能上,导致了ΔΨm的下降以及兴奋剂诱导的线粒体Ca2+吸收。总之,过表达MITOK导致了严重的线粒体形态和功能紊乱。Valinomycin(K+离子载体,介导了K+内流入基质)可以非常类似地模拟MITOK过表达的表型;利用重组蛋白和平面脂双层,在仅含有K+一种阳离子的培养液中检测到其通道活性,这个通道显示出ohmic behavior、电压依赖、K+选择性(PK:PCl = 1:0.02);另外,它的通道活性能够被一种K+通道抑制剂barium而非BKCa通道抑制剂paxilline抑制。这些结果明确无误地鉴定了MITOK是一个线粒体K通道蛋白。
然而,MITOK纯化蛋白并不能响应ATP和mitoKATP抑制剂5-HD。进一步研究发现,它的ATP敏感性可以被一个调节性磺酰脲受体样(SUR-like)亚单位ABCB8(因此命名为MITOSUR)赋予。体外共同表达MITOK与MITOSUR后,热稳定试验与膜提取物实验证明它们被共同折叠到脂质体中。4个MITOK与4个MITOSUR亚基能够形成一个八聚体的K+可透过的通道(图一);可被毫摩尔级别浓度的ATP抑制;可被diazoxide激活;可被磺酰脲类格列本脲和5-HD阻断。这些特征包含了mitoKATP应具有的所有功能性电生理特性以及药理学特征。因此,MITOK形成K+透过性通道,而MITOSUR作为调节性亚单位包含ATP结合位点,二者共同形成了能够响应ATP的线粒体K+通道。
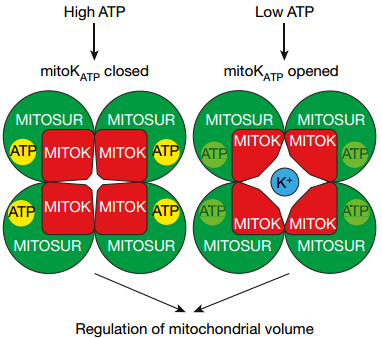
图一 MITOK与MITOSUR组成mitoKATP响应ATP介导K+内流调节线粒体体积
随后,作者对MITOK/MITOSUR复合体的基本生理学功能进行了研究。CRISPR/Cas9敲除MITOK后,导致了以下功能的改变:(1)K+内流对ATP与diazoxide不再敏感,证明MITOK对ATP依赖的K+内流入线粒体是必须的;(2)形态上,敲除MITOK导致了几种油炸圈饼形状的线粒体,这与细胞器K+平衡损伤有关;(3)细胞经历单个线粒体的异步的、快速的以及瞬时去极化;(4)基本和最大氧消耗率的下降。为了深入研究细胞器功能改变的原因,研究人员通过透射电子显微镜研究了线粒体超结构。结果发现,敲除MITOK使得K+内流减少,基质体积发生紧缩,从而导致嵴内腔的加宽。
那么mitoKATP通道是怎样影响线粒体适应能量胁迫的呢?作者使用糖酵解抑制剂2-脱氧葡萄糖快速下调整体细胞内代谢,导致ATP缺乏,发现线粒体能够发生片段化;代谢胁迫与diazoxide处理下,ROS的产量增加。而这两个过程都必须MITOK的参与。这些数据表明mitoKATP通道调控了线粒体对胞内胁迫的适应,可能是通过调节基质体积。
最后,作者构建了MITOK敲除小鼠。这些小鼠在出生率、外貌和体重增长率等方面无明显表型(至少直到4个月)。但是敲除小鼠的mitoKATP活性确实受到影响,ATP和diazoxide都不能改变K+内流。最后,做了体外局部缺血-再灌注实验,发现敲除MITOK小鼠几乎完全丧失了diazoxide诱导的药物预处理心脏保护作用,暗示了mitoKATP是diazoxide的靶标分子。
总之,作者鉴定了一个线粒体ATP敏感性钾通道复合物,其由4个通道形成亚单位(MITOK)以及4个含有ATP结合位点的调节性亚单位(MITOSUR)组成。这种mitoKATP可能是协调细胞内能量状态与能量产生的潜在机制,参与了胁迫条件下胞内代谢的稳态控制。
原文链接:
https://doi.org/10.1038/s41586-019-1498-3
参考文献
1. Ashcroft, F.M. & Rorsman, P. KATP channels and islet hormone secretion: new insightsand controversies. Nat. Rev. Endocrinol. 9, 660–669 (2013).
2. Nichols, C.G. KATP channels as molecular sensors of cellular metabolism. Nature 440,470–476 (2006).
3. Garlid, K.D. et al. Cardioprotective efect of diazoxide and its interaction withmitochondrial ATP-sensitive K+ channels. Possible mechanism ofcardioprotection. Circ. Res. 81, 1072–1082 (1997).
4. O’Rourke, B.Evidence for mitochondrial K+ channels and their role in cardioprotection.Circ. Res. 94, 420–432 (2004).
5. Smith, C.O., Nehrke, K. & Brookes, P. S. The Slo(w) path to identifying themitochondrial channels responsible for ischemic protection. Biochem. J. 474,2067–2094 (2017).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474776&idx=3&sn=5d00680fb9b1a437d59cf2d89952e1d1&chksm=84e21e2cb395973a61604cf68f58b97efaa76302a9383fe5ac0b6694e28a330483d74c77cc03&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
ATP分泌与代谢调控 |“儒谈线粒体”学术沙龙系列论坛第二十讲

化学所发表ATP合酶体外重组综述文章
mTORC2控制线粒体膜通透性,调节自噬流量并影响寿命长短

Nature:在线粒体中鉴定出一种ATP敏感性的钾离子通道
1天同时发表4篇Cell Metabolism文章,中国学者在代谢领域取得新突破

中文解读 | 脑出血后铁毒性、脂质过氧化和铁死亡

厦门大学林圣彩团队迎来开门红

线粒体光学检测与调控|“儒谈线粒体”学术沙龙系列论坛第六讲

香港科技大学唐本忠院士:原位监测细胞凋亡过程的自报告光敏剂
线粒体也能来自父亲