科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-03
来源:BioArt
多发性硬化症(Multiple Sclerosis)是一类以中枢神经脱髓鞘损伤为病变基础的神经炎症性免疫疾病,全球约有250多万名患者,是青壮年致残性神经疾病之一(Dendrou et al., 2015)。主要的发病机制是患者体内产生特异性识别髓鞘少突胶质细胞糖蛋白(MOG)的效应T细胞,该T细胞向中枢神经系统(Central nervous system, CNS)迁移,攻击少突胶质细胞构成的包裹神经元突触的髓鞘,造成脱髓鞘损伤,影响神经信号传导,最终导致运动功能障碍、视力障碍、疲乏、认知损伤,甚至瘫痪等临床症状(Dendrou et al., 2015; Stromnes et al., 2008)。T细胞在发病过程中的异常激活对疾病的发生发展具有关键作用,因此,深入了解多发硬化症T细胞异常激活背后的免疫细胞分子事件对理解该病发生的免疫学机理,进而开发有效诊治方法具有重要意义。
近日,Journal of Experimental Medicine杂志在线发表了来自南京医科大学杨硕教授课题组和南京中医药大学胡刚教授和王冰微教授课题组的合作研究成果:Gasdermin D inperipheral myeloid cells drives neuroinflammation in experimental autoimmuneencephalomyelitis。该研究发现细胞焦亡效应分子Gasdermin D(GSDMD)蛋白在模拟MS发病的实验性变态反应性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)小鼠中,能够通过介导外周髓系细胞炎性死亡,引发炎症微环境形成,进而促进T细胞在外周淋巴器官中的激活和分化,加剧疾病的发展,当给予细胞焦亡抑制剂后可显著缓解小鼠多发硬化症临床症状。

GSDMD是近年由我国邵峰院士发现的介导细胞炎性死亡(细胞焦亡)关键效应分子,被称为“细胞焦亡执行者”,它可以由炎症小体经典或非经典途径激活,通过在细胞膜上打孔引起细胞炎性死亡发生,在炎症反应过程中有着重要作用(Shi et al., 2015)。研究人员发现,在EAE发病小鼠的中枢和外周淋巴组织中有大量的GSDMD和其上游分子Caspase-1/11激活,并且GSDMD阳性细胞主要聚集在损伤区域扩张的毛细血管周围。同时,EAE小鼠中枢外周迁徙来的Ly6C阳性的焦亡细胞比例明显增高。这些结果表明,小鼠EAE病程伴随着细胞焦亡发生,并且主要发生在外周浸润的髓系细胞中。
研究人员接下来发现GSDMD敲除小鼠EAE发病明显减轻,脱髓鞘损伤程度和外周免疫细胞的浸润水平都明显下降。利用骨髓移植实验,研究人员发现来自于GSDMD敲除小鼠的外周免疫细胞能减轻EAE的发病。此外,通过特异性敲除小鼠研究,研究人员进一步确定了GSDMD是通过外周髓系细胞而非小胶质和T细胞来发挥对EAE的影响。研究人员还发现EAE高峰期GSDMD敲除小鼠的脾脏和淋巴结相较于野生型小鼠明显肿大。分析外周淋巴器官中免疫细胞的组成表明,EAE发病后GSDMD敲除小鼠的髓系CD11b、 CD11c以及MHCII阳性细胞比例和数量明显下降,但CD4+ T细胞明显增加,特别是naïve T细胞,而分化后的效应T细胞减少。这些结果表明,GSDMD敲除后干扰了外周髓系细胞对T淋巴细胞的应答激活,导致效应T细胞的分化和迁移能力都有所下降。体外DC细胞和T细胞共培养实验,也佐证了这一结论。对从EAE发病初期小鼠脾脏中分离出来的CD11b和CD4细胞进行RNA-seq分析,也发现GSDMD敲除后抑制了T细胞激活、分化、迁移相关基因的表达。此外,通过过继转移实验研究人员进一步证明GSDMD是通过调控T细胞来影响EAE的发病进程。最后,给予外源性细胞焦亡抑制剂双硫仑,研究人员发现能够显著缓解小鼠的EAE发病。
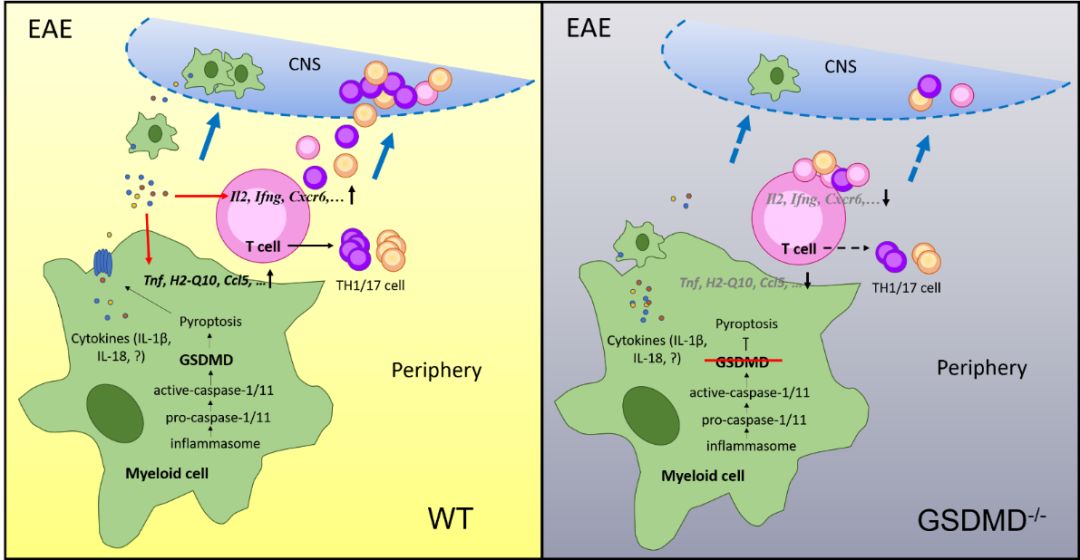
综上,该研究为理解多发性硬化症发生的免疫学机理提供了新的视角,并为多发性硬化症治疗和以GSDMD为靶点的药物开发提供了理论基础。
原文链接:
http://jem.rupress.org/content/early/2019/08/28/jem.20190377
参考文献
1. Dendrou, C.A., L. Fugger, and M.A.Friese. 2015. Immunopathology of multiple sclerosis. Nature reviews. Immunology 15:545-558.
2. Shi,J., Y. Zhao, K. Wang, X. Shi, Y. Wang, H. Huang, Y. Zhuang, T. Cai, F. Wang,and F. Shao. 2015. Cleavage of GSDMD by inflammatory caspases determinespyroptotic cell death. Nature526:660-665.
3. Stromnes,I.M., L.M. Cerretti, D. Liggitt, R.A. Harris, and J.M. Goverman. 2008.Differential regulation of central nervous system autoimmunity by T(H)1 andT(H)17 cells. Nature medicine14:337-342
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474776&idx=6&sn=9016da1b77d00083d980fbf7544c903b&chksm=84e21e2cb395973adbc8c884509de2db9a6e0e6e09c6a87a4876e868c667d785f05d0aacf8cf&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Nature:肠道微生物可以加剧多发性硬化症

【媒眼看世界】第48期:多发性硬化症为何难治

【宣城科普】 特立氟胺可治愈多发性硬化症?

Nature:多发性硬化症患者大脑的疾病根源——投射神经元
Cell:探索多发性硬化症的环境因素
一种抗抑郁剂或可治疗多发性硬化症
脑膜淋巴管在多发性硬化症中“作用”重要

“肥宅快乐”要不得!BMJ再次证明这些饮食和死亡风险有关

《Cell》探索“食疗”对多发性硬化症的治疗原理

Neurology:多发性硬化症患者癌症发生率和死亡率