科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-09
来源:BioArt
抗菌肽(Antimicrobial peptides, AMPs)是广泛存在于生物体内的天然多肽,主要用于对抗皮肤等组织的局部感染【1】。阳离子型AMPs通过膜溶解的方式杀灭细菌,且不易诱发抗菌素耐药性【2】,因此,面对全球范围内日益严重的细菌多重耐药性这一威胁,AMPs是一种潜在的有效解决方案。然而,线性AMPs结构不稳定,具有蛋白水解不稳定性,易造成非特异性膜毒性,使其临床转化应用举步维艰。自AMPs发现以来,近三十年的诸多突破性研究已经阐明了天然和非天然AMPs的性质,但并未产生以AMP为基础的抗生素药物。
为克服AMPs的蛋白水解不稳定性,一种方式是应用D-氨基酸,通过将赖氨酸残基定位在D-氨基酸序列的非极性面中部,确定一个关键的“特异性决定因素”,然而基于D-氨基酸的多肽合成较为昂贵,溶液中存在不可预测结构,仍需要进一步针对性优化【3】。另外一种降低多肽水解不稳定性的方式是通过插入全烃交联的钉合肽(all-hydrocarbon staples),以形成一种α-螺旋结构。全烃交联的钉合能够最大限度地利用生物活性螺旋作为相互作用的靶标蛋白【4】。已有研究将staples组装至AMP序列,能够改善AMPs的α-螺旋性,并增强对蛋白水解的抵抗力。然而,可变的抗菌活性和非特异膜溶解性又体现出其疗效的局限性。近年来发现的一种具有胞内靶向性的钉合肽(stapled peptides)被认为有助于限制非特异性AMP的毒性。
2019年8月19日,来自美国Dana-Farber癌症研究所的Loren D. Walensky教授团队在Nature Biotechnology上发表题为Design of stapled antimicrobialpeptides that are stable, nontoxic and kill antibiotic-resistant bacteria inmice的论文,通过分析钉合AMP(StapledAMPs, StAMPs)的筛选和突变文库,揭示了StAMPs结构-功能-毒性之间的关系,并以此开发了一种用来设计稳定、高效并具有体内膜选择性钉合AMP的预测算法。

作者早期研究胞内定位的钉合肽时,发现特定构造能够通过胞饮作用机制,实现稳定的哺乳动物细胞摄取功能【5】,作者因而测试并筛选了导致非特异性膜溶解的两亲α-螺旋序列。以研究最为广泛的AMPs之一的蛙皮素II(Magainin II, Mag II)为对象,作者发现钉合结构能增强高疏水性斑块在两亲性Mag II α螺旋疏水表面的融合,引发溶血活性,而在不增加疏水互作表面的疏水区域大小的情况下,增加整体的疏水性并不能产生类似效果。
随后,作者将来源于StAMP经验观察所产生的概念上的进展转化为一种能够应用于临床的StAMP优化设计算法。作者发现高溶血活性的钉合结构具有最大最强的疏水相互作用网络,另一方面,与革兰氏阴性菌相比,裂解革兰氏阳性菌需要一个更强大的疏水相互作用网络,这为调整针对耐药革兰氏阴性菌的StAMP活性谱和扩大细菌对哺乳动物细胞膜的选择性窗口提供了机会,表明lyticity index(LI)值与溶血率呈现较强的对数相关。作者进一步通过氢-氘交换质谱(HX-MS)和石英晶体微天平(QCM)分析的方法,发现StAMP疏水表面的强大疏水网络导致了地毯式的相互作用机制,且这种机制与两性离子膜,特别是坚固的磷脂双分子层很少或者没有接触。Mag(i+4)1,15(A9K)在裂解细菌膜时的功能特异性,再次证实了这种跨膜插入模型中,细菌选择特异性的StAMP具有膜破坏活性。
为优化Mag(i+4)1,15(A9K)特性,作者在多重耐药的革兰氏阴性临床分离菌株中,对这种化合物进行更广泛的临床前检测,发现Mag(i+4)1,15(A9K)对血清肌酐无明显影响。并通过阳离子抗生素与肾脏毒性的关系,进一步优化double stapled StAMP消除潜在的肾脏损伤作用。在推导出基于Mag2模型的细菌膜选择标记的设计原则和预测算法后,作者揭示了这种计算工具能够快速地为不同模板序列的临床前开发提供先导标记(图1)。
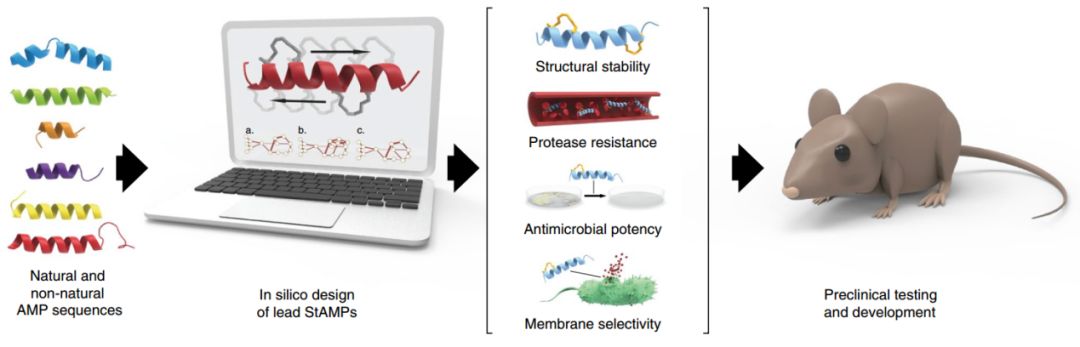
图1 用于临床前测试和临床翻译的StAMP计算设计流程
综上,作者运用设计算法发现Mag(i+4)1,15(A9K)作为选择性StAMP具有极低的溶血活性,能够通过跨膜插入的方式溶解细菌,避免蛋白水解形式的降解,且不会诱发细菌的耐药性,每日两次静脉给药小鼠能够耐受。将这个算法应用于另外三个不同的AMP序列,生成了抗菌活性强、几乎无溶血毒性且不需要合成或筛选类似物的StAMP原形。本研究开发了一种对抗多重耐药性细菌感染的新型抗生素,推进了StAMPs的研究发展。
原文链接:
https://doi.org/10.1038/s41587-019-0222-z
参考文献
【1】Brogden, K. A. Antimicrobialpeptides: pore formers or metabolic inhibitors in bacteria? Nat. Rev.Microbiol. 3, 238–250 (2005).
【2】Fjell, C. D., Hiss, J. A., Hancock,R. E. & Schneider, G. Designing antimicrobial peptides: form followsfunction. Nat. Rev. Drug Discov. 11, 37–51 (2012).
【3】Jiang, Z., Vasil, A. I., Gera, L.,Vasil, M. L. & Hodges, R. S. Rational design of alpha-helical antimicrobialpeptides to target Gram-negative pathogens, Acinetobacter baumannii andPseudomonas aeruginosa: utilization of charge, “specifcity determinants,” totalhydrophobicity, hydrophobe type and location as design parameters to improvethe therapeutic ratio. Chem. Biol. Drug Des. 77, 225–240 (2011).
【4】Bird, G. H. et al. Hydrocarbondouble-stapling remedies the proteolytic instability of a lengthy peptidetherapeutic. Proc. Natl Acad. Sci. USA 107, 14093–14098 (2010).
【5】Walensky, L. D. et al. Activationof apoptosis in vivo by a hydrocarbonstapled BH3 helix. Science 305, 1466–1470(2004).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475079&idx=3&sn=32f8e78d706267aef2ac8fc871e5482a&chksm=84e21d73b39594659b3bd4c95e7bcba6044919e76a0fae96b55aa2aaac037dfc436399b57cae&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
细菌“亲密行为”或解释抗生素耐药性成因

口腔与细菌性肠疾的关系被揭示
2018年细菌耐药性威胁与应对研讨会通知


细菌“亲密行为”或解释抗生素耐药性成因

哈佛大学研究显示:结肠癌细胞会在转移时携带细菌
张勇博士等揭示细菌适应环境新机制——为对抗细菌耐药性提供新思路
从“细菌耐药性”认识2OG加氧酶
科学家发现新型“超级细菌”对抗生素有耐药性

细菌耐药性不断增强或与狗粮有关?

自然中不存在的蛋白质也能人造了!撼动材料医药界