科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-24
来源:Deep Omics
文章题目:Single-cell analysis of cardiogenesis reveals basis for organ-level developmental defects
发表时间:2019年7月24日
期刊名称:Nature
PMID:31341279
关键词:单细胞RNA 测序,心脏,发育图谱,转录因子

单细胞生物学是最近几年的热门研究方向,主要从单个细胞的水平研究功能机制。单细胞测序作为最前沿的研究技术,可以对单个细胞的基因组或转录组进行高通量测序,实现单个细胞内遗传变异、基因表达、表达调控等信息的收集。自 2009 年第一个单细胞转录组测序技术开发完成以来,该技术对单细胞数量的检测通量也在逐步提高,现已进入高通量单细胞测序阶段。单细胞转录组测序技术在肿瘤、发育生物学、微生物学、神经科学等领域发挥重要作用,正成为生命科学研究的焦点。本次分享的文章是来自美国格莱斯顿心血管疾病研究所的Deepak Srivastava和Casey A. Gifford研究组2019年7月24日发表在《自然》上的一项研究[1]。
器官发生涉及多种细胞类型的整合;细胞类型特异性基因网络的失调会导致出生缺陷,这影响到5%的胎儿出生。先天性心脏缺陷是最常见的畸形,这由不同亚群的心脏前体细胞紊乱所导致,但不同的前体细胞中转录的改变如何导致器官水平的缺陷却未知。研究人员利用单细胞RNA测序技术研究了正常(野生型小鼠)和不正常的(Hand2基因缺失型小鼠)早期心脏前体细胞的发育轨迹,揭示了特定的细胞亚群失调如何带来灾难性后果。
心肌细胞发育图谱和转录特征
尽管遗传分析揭示了可能导致先天性心脏缺陷的突变[2],但鉴定特定细胞类型及其衍生的受这些突变影响的祖细胞仍然是一个挑战。为了解决这个问题,文章作者通过对三个发育阶段(胚胎期7.75天,胚胎期8.25天和胚胎期9.25天,共9个样本)小鼠的心源区收集到的36,000个单细胞进行测序,确定了心肌细胞规格和形态发生的转录特征 (图1a-c)。这36,000个单细胞中有21,366个是来自中胚层和神经嵴,文章作者将这21,366个单细胞的转录组划分成了7个不同的细胞亚群 (图1d,e),这些群体可以进一步分为不同的祖细胞群。文章同时对这七个群体特征进行了特征分析和功能注释,表明这七个细胞群分别代表了心室、心房、静脉窦、房室管和流出道心肌细胞。通过这份目录,研究人员能够更深入地研究这些心脏祖细胞的作用。通过与之前文献报道的早期心脏祖细胞的单细胞转录组测序结果比较,文章作者对心脏祖细胞的异质性特征进行转录表达分析(图2a-b),并描绘了心肌亚型的早期特异性的动态发育过程(图2c-e)。
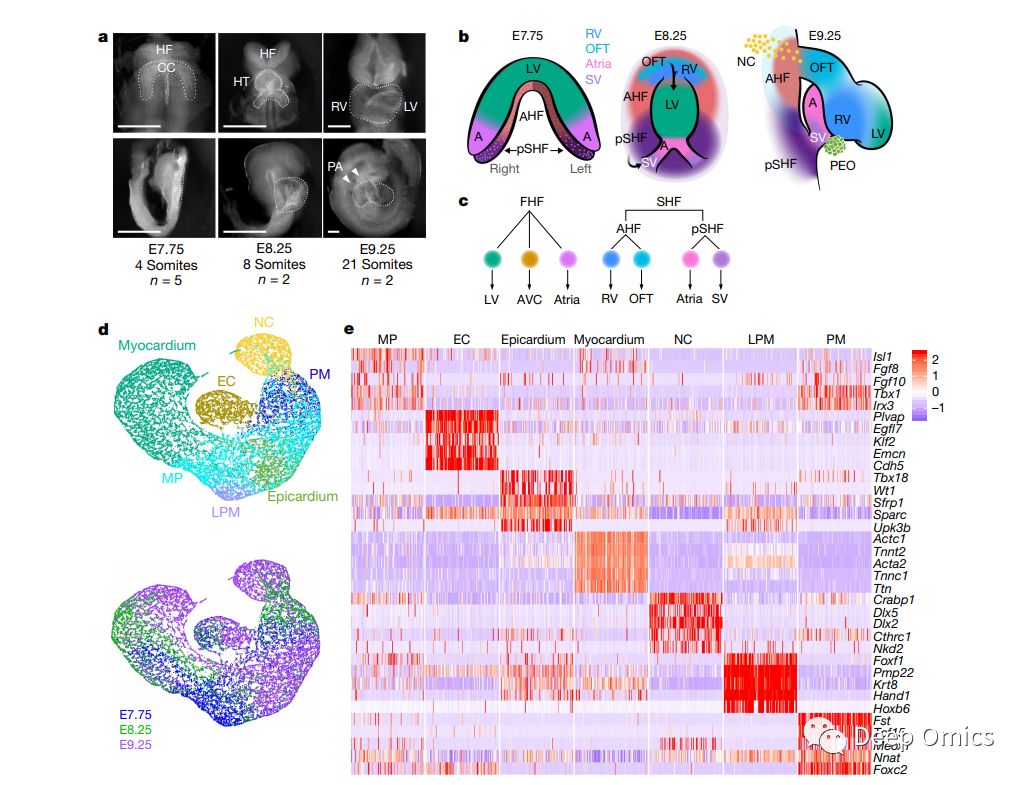
图1 单细胞RNA测序揭示了早期胚胎发育过程中心源区的异质性
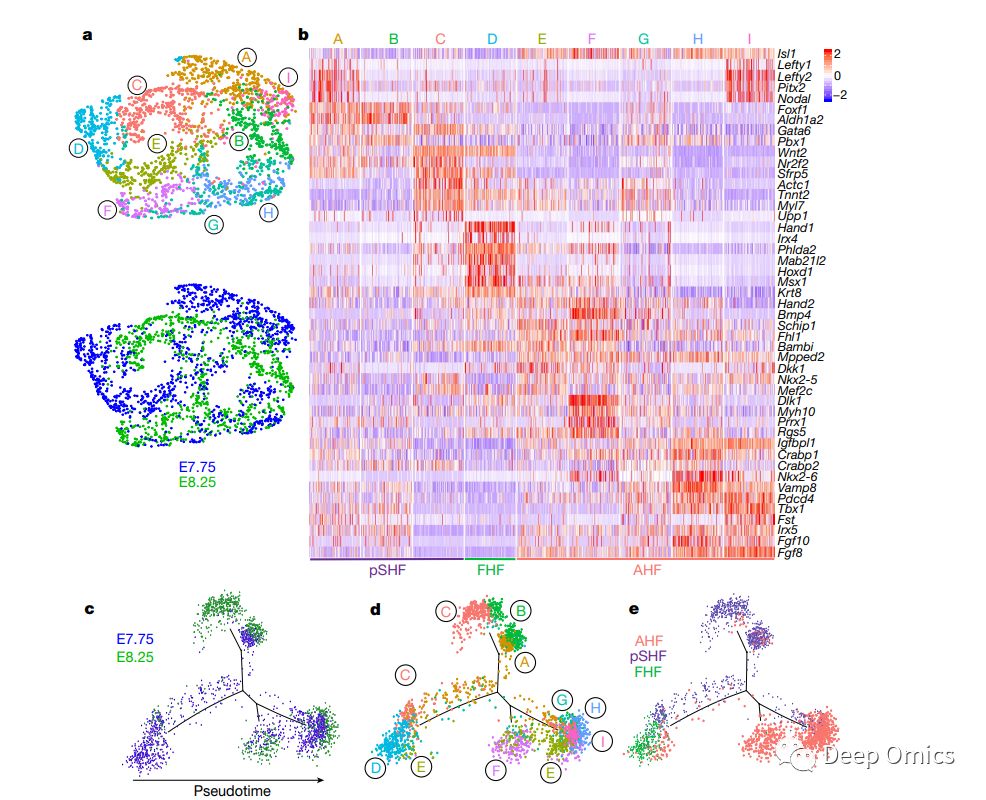 图2 心肌细胞亚型分析揭示早期发育动态特征
图2 心肌细胞亚型分析揭示早期发育动态特征
心脏发育缺陷调控因子及机制
调控心脏祖细胞进入不同亚系的分子机制依然是未知的,文章作者通过一种基于Boolean网络的计算方法对单细胞测序结果进行分析。通过该分析他们预测出了谱系特异的转录因子,确定了Irx4和Plag1是右心室心肌细胞的特异性分子,Hand2、Tead2和Arid3b是流出道心肌细胞命运的决定性因素。研究人员在两个发育时间点(E7.75,E8.25),比较了野生型和Hand2缺失心脏祖细胞的单细胞转录组。结果显示对于Hand2缺失细胞,前心区、流出道和右心室前体细胞在发育早期出现转录失调,远远早于任何形态学特征的出现(图3a-c)。因此他们推断,尽管Hand2的缺失导致小鼠体内无法正常形成右心室, Hand2的缺失同样导致了视黄酸通路的失调以及心脏前体细胞前-后轴成型的紊乱(图3d-g)。
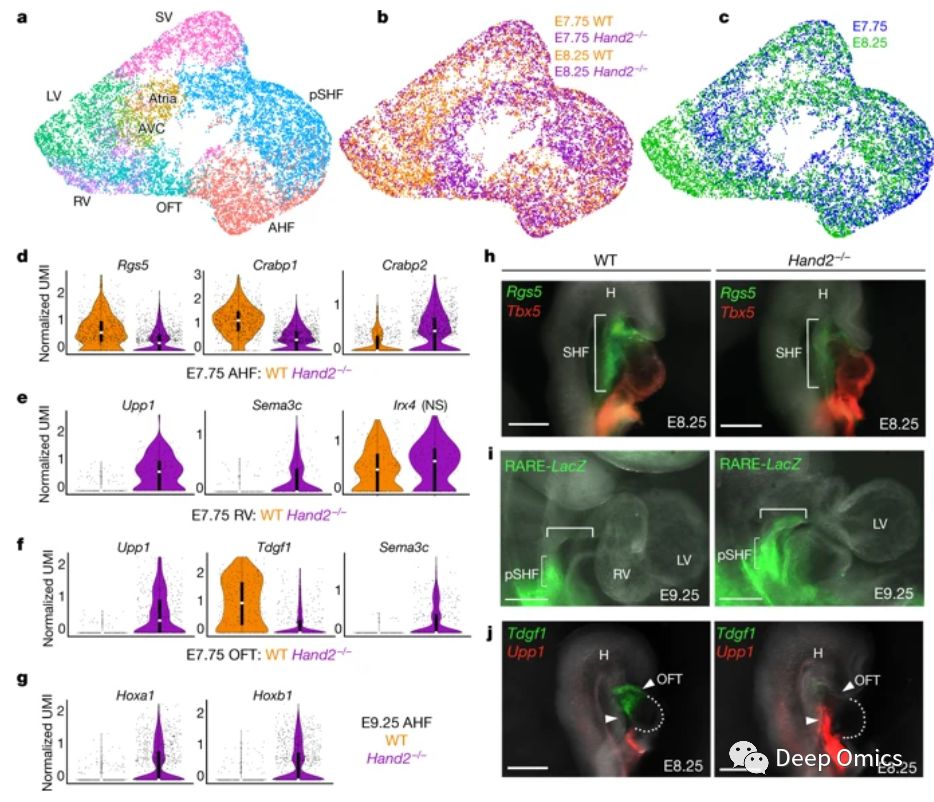
图3 Hand2缺失导致的视黄酸信号通路失调
我们的思考
这项工作揭示了在不同心脏前体细胞在命运特化与分化中转录决定因子,并在单细胞分辨率水平揭露了心脏发育紊乱的机制,从而为研究先天性心脏缺陷提供了框架。
该篇文章个人认为不再是传统意义上的图谱类或发育类文章,文章还应用了生物学实验来验证自己的结果。文章使用了基因敲除这种经典的技术手段在个体水平上证明了Hand2在决定细胞命运方面的作用,并揭示了该基因通过视黄酸信号通路来调控心脏前体细胞前-后轴成型的分子机制,这是一项很了不起的结果。
单细胞技术只是技术,和其他测序技术一样也会经历快速发展,成本降低,最终过时的命运。因此,在发育生物学领域,单细胞测序能够锦上添花的固然好,关键还是要与生物实验结合起来!
参考文献
1. de Soysa T Y, Ranade S S, Okawa S, et al. Single-cell analysis of cardiogenesis reveals basis for organ-level developmental defects[J]. Nature, 2019: 1.
2. Jin S C, Homsy J, Zaidi S, et al. Contribution of rare inherited and de novo variants in 2,871 congenital heart disease probands[J]. Nature genetics, 2017, 49(11): 1593.
来源:gh_cc101106ed81 Deep Omics
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2NDg2MjgyOA==&mid=2247483723&idx=1&sn=fb8c383594611b237e99c9bc97b3037c&chksm=eaa76c48ddd0e55e280ad0e69a9d5ab17119c20a6fbfd7bae5e2e2ac1bf39725beadb1d939af&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Nature论文称,替代新烟碱的杀虫剂仍会伤害蜂群
利用Nanopore高通量测序技术解析污水处理体系可移动抗性基因组
MPB:沈阳生态所李琪组-土壤线虫群落DNA提取、扩增及高通量测序
浙大刘建钊、北大贾桂芳团队分别开发新的m6A高通量测序方法

疾控福利~纯干货的高通量测序培训班
厦门大学杨朝勇教授课题组在高通量单细胞转录组测序研究中取得新进展

大型恒星比想象的更多
武汉大学今日Nature;华大基因Nature

新突破! 二维实验系统成功应用于四维材料研究
魏勇等-Nature Astronomy:中国的行星探索路线图