科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-22
来源:中山大学

孙逸仙纪念医院乳腺肿瘤中心团队
9月17日,我校孙逸仙纪念医院宋尔卫教授、苏士成副研究员团队的一项研究成果在线发表于《自然》子刊《自然·免疫学》杂志上。

长非编码RNA NKILA调控不同亚群T细胞凋亡敏感性的机制
该研究发现了长非编码RNA NKILA能促使肿瘤特异T细胞被诱导凋亡,以至于不能开“猛火”攻打肿瘤。研究还提示,可在体外将T细胞中的NKILA敲除,从而保证回输到体内的T细胞的“火力”,增强免疫治疗的效果。
免疫治疗在2013、2017两年被Science杂志评为十大年度科学突破。尤其在治疗淋巴瘤、黑色素瘤等方面,免疫治疗效果显著。然而针对乳腺癌等实体肿瘤,免疫治疗疗效仍比较微弱,这说明其中还有很多未知的机制需要进一步探索。
宋尔卫教授、苏士成副研究员团队便针对他们擅长的乳腺癌研究展开了探索。他们发现,肿瘤会“引诱”肿瘤特异T细胞对它“手下留情”。
这其中的内在机制是什么?研究者发现了一个关键角色“长非编码RNA NKILA”。当T细胞安静时即还没有激活时,NKILA同样很安静,呈低表达的状态;然而,T细胞忙碌起来的时候,NKILA也开始大量表达。
此刻,我们还要来认识一条重要的“生死通路”——NF-κB通路。它激活时T细胞能抵抗肿瘤细胞的攻击,从而打击肿瘤。研究者发现,NKILA一旦大量表达,便会抑制NF-κB通路,那么T细胞的“火力”就会被大大减弱,肿瘤细胞也会“嚣张”起来。
那么,该怎么用好这一系列机制呢?
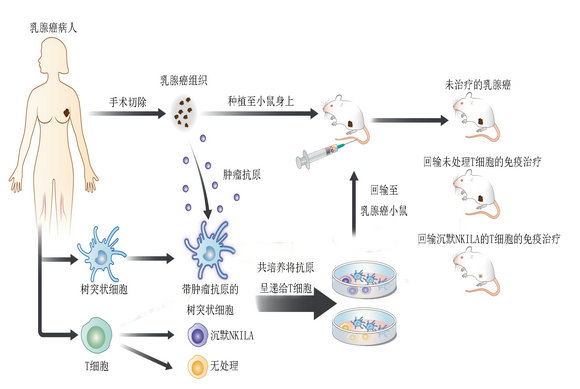
过继性回输沉默NKILA的T细胞在临床前PDX模型中显示疗效
研究团队在体外对T细胞进行了修饰,沉默了NKILA的表达,再将T细胞回输至患了乳腺癌的小鼠模型体内,NF-κB通路便会维持在激活状态。他们发现,如此一来肿瘤内的T细胞明显增多,被杀伤的肿瘤细胞增多,肿瘤明显缩小。
9月17日这项研究成果,以“NKILA LncRNA promotes tumor immune evasion by sensitizing T cells to activation-induced cell death”(《长非编码RNA NKILA 通过使T细胞对凋亡敏感促进肿瘤的免疫逃逸》)为题在线发表于《自然》子刊《自然·免疫学》杂志上。
宋尔卫教授说,目前依托孙逸仙纪念医院免疫治疗中心的平台,团队计划开展I期临床研究,即初步对临床药理学及人体安全性评价试验。
“基于前期研究结果,我们会在体外敲除T细胞的NKILA,再将T细胞输至肿瘤患者。我们有信心能让T细胞更好地集中火力向肿瘤细胞‘开炮’。”宋尔卫说,和肿瘤细胞基因治疗相比,这一方法是在体外修饰细胞,更可靠、安全。
论文链接:https://www.nature.com/articles/s41590-018-0207-y
宋尔卫教授团队简介:
宋尔卫教授带领的乳腺肿瘤研究团队,从临床问题出发,将外科临床和基础研究结合起来。他在非编码RNA和肿瘤微环境调控肿瘤转移领域取得了多项突破性和系统性的成果。主要包括:1、系统研究了miRNA对肿瘤细胞可塑性的调控作用。2、发现lncRNA可作为信号分子调控NFκB的活性并影响肿瘤转移,提出了lncRNA与蛋白质结合的新模型。3、发现了人类巨噬细胞特有的趋化因子CCL18的受体,在此基础上深入阐明了趋化因子及其受体组成的巨噬细胞-肿瘤细胞信号环路促进肿瘤转移的机制。4、发现了肿瘤微环境中一类特殊亚型的肿瘤相关成纤维细胞能诱导肿瘤细胞的化疗耐受。由于团队的杰出成就,宋尔卫教授被Springer出版社邀请主编《长短RNA与肿瘤生物学》英文专著,担任Cell出版社主办的“功能RNA”国际会议大会共同主席,多次在国际会议报告或担任分会场主席。这些表明他已成为国际上该领域有重要影响的学者。宋尔卫教授带领的乳腺肿瘤创新研究团队以第一或通讯作者发表SCI论文125篇,被SCI他引5000多次,其中13篇SCI他引超过100次。
肿瘤营养不良患者细胞免疫治疗
细胞治疗专栏文章(一):CAR-T和免疫细胞肿瘤治疗


Nature综述珍藏版!肿瘤中的免疫细胞代谢

用“史上最复杂疗法”对付癌症 “基因剪刀”助力免疫细胞攻击肿瘤
免疫疗法利器!Nature:重编调控性T细胞亚群促进肿瘤免疫反应
Cell:肥胖会抑制免疫细胞的功能,加速肿瘤生长

新疗法有助免疫细胞从血管中进入肿瘤 系统根除脑肿瘤
单细胞测序揭示肺癌肿瘤免疫细胞亚型的细胞图谱

揭秘肥胖与癌症的“坏勾当”!多余脂肪竟帮癌细胞“抑制”免疫细胞,加速肿瘤生长
《细胞》子刊:找到免疫细胞突袭肿瘤的“快速通道”