科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-14
来源:逻辑神经科学
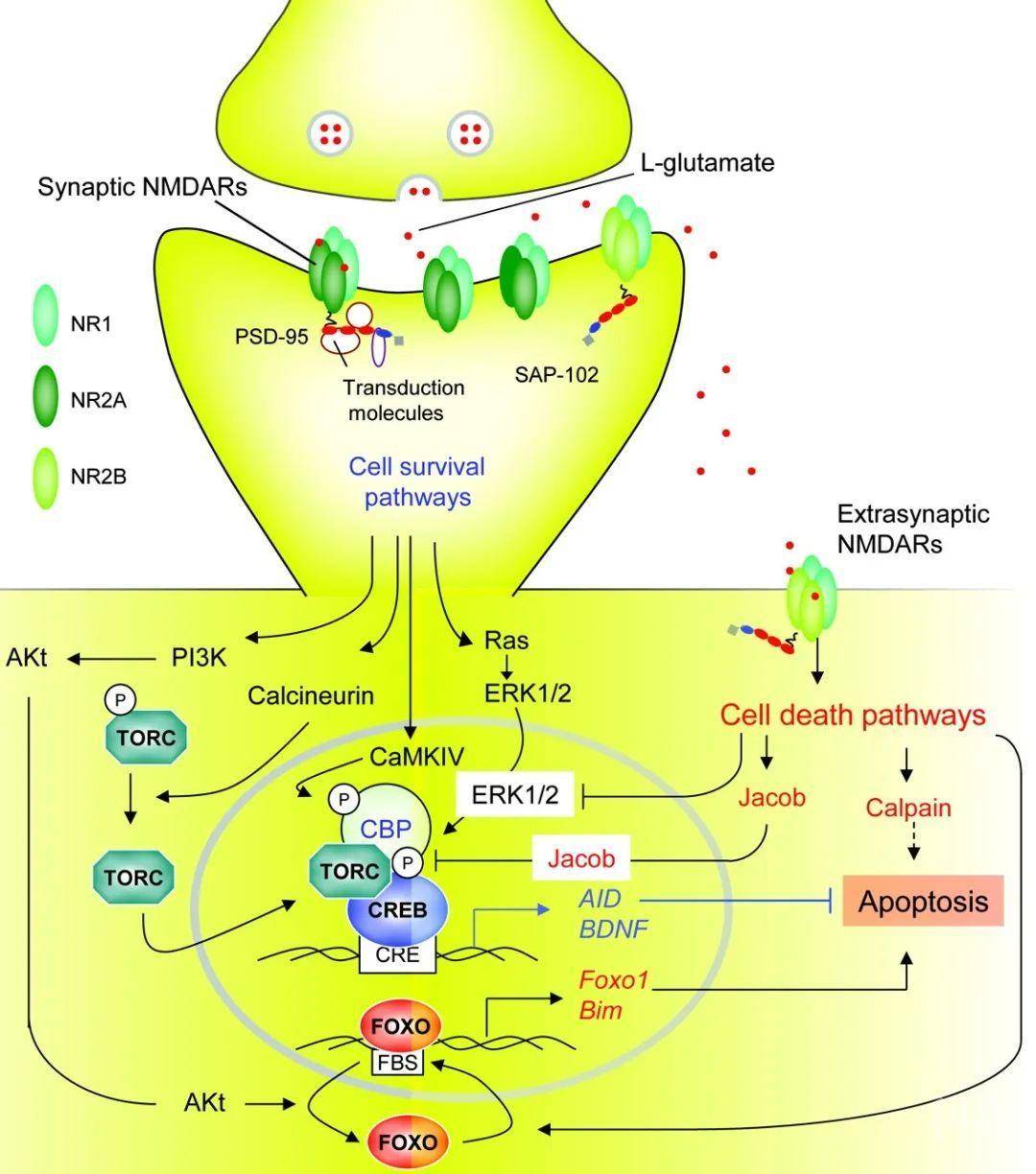
N-甲基-D-天冬氨酸受体(NMDAs)
(图片引自:Eduardo E. Benarroch, Neurology 2011, 76 (20) 1750-1757)
新的研究表明,N-甲基-D-天冬氨酸受体(简称NMDARs)是哺乳动物中枢神经系统中生理和病理的基础;也是一类谷氨酸门控,钙渗透性神经递质受体【1-2】。NMDARs控制成人突触的可塑性,以及启动巩固神经系统适应性过程所必需的转录反应,比如记忆和获得性神经保护等【3-4】。然而NMDARs对神经元也有有害的一面,它们可以启动转录关闭通路,导致线粒体功能障碍,甚至导致过量谷氨酸引起的兴奋性毒性细胞死亡【5-6】。尽管NMDA受体所诱导的兴奋性毒性被认为与细胞内钙离子的高负荷密切有关【2、7】。但是毒性NMDAR信号传导的分子基础尚不清楚。
于是,德国海德堡大学神经科学跨学科中心的Hilmar Bading教授课题组做了这样一个推测:NMDARs的毒性来源于其和一种或多种蛋白质的物理相互作用,而这些蛋白位于突触外而非突触处。鉴定NMDARs相关的蛋白、以及揭示它们各自相互作用的结构域,将有可能促进一些创新方法的发展,比如破坏死亡信号复合物的新方法。而且开发分子相互作用界面的抑制剂或更具有潜在价值,这是因为此类抑制剂具有神经保护作用,与传统NMDAR阻断剂的作用机制和效果是不一样的:在不影响突触处NMDAR的正常生理功能的情况下,通过剥离突触外NMDAR信号转导中的毒性成分,从而起到神经保护的作用。
因此,鉴于上述科学推测、研究思路、及科研目的,于是课题组进行了详细研究。成果已于2020年10月9日以Coupling of NMDA receptors and TRPM4 guides discovery of unconventional neuroprotectants为题在线发表在Science上。研究揭示了NMDAR介导的兴奋性毒性来源,及其与另一个分子RPM4相互作用的机制、和介导毒性的具体结构域;并发现了一类具有新作用模式的神经保护剂,即NMDAR/TRPM4相互作用界面抑制剂。

具体地,首先,Jing Yan博士(文章一作)等人关注了已知的能够与NMDAR相关作用的一个蛋白质,TRPM4 ,即瞬时受体电位(TRP)通道家族中美伐他汀(TRPM)亚家族成员之一【8-9】。之前的研究已表明,TRPM亚家族与神经退行性变有关,TRPM4是一种同分异构体的且钙不渗透的阳离子通道蛋白,可以被细胞内的钙离子、去极化和温度激活;而且TRPM4又是NMDAR死亡信号转导复合物的关键组成部分【8-10】。
首先,Jing Yan等人的体外实验结果表明,在原代海马神经元中敲除TRPM4会显著减少由NMDAR所导致的细胞兴奋性毒性,但不影响细胞凋亡;NMDAR亚基GluN2A和GluN2B能够与TRPM4发生物理相互作用,并形成NMDAR/TRPM4复合物(下文简称复合物)。
那么,破坏该复合物的结构是否会减轻、或消除由NMDAR介导的毒性呢?作者发现,在TRPM4的N端,有一段含有57个氨基酸的区域,简称TwinF,介导了TRPM4与NMDAR的相互作用,这段区域刚好位于细胞质膜的下方位置(即朝向细胞质的方向)。TwinF能够消除NMDAR介导的海马神经元的兴奋性毒性细胞死亡。在由氧糖剥夺所诱导细胞死亡的神经元中、脑损伤缺血性中风模型中、TwinF也有强大的神经保护作用。TwinF也不影响海马神经元中NMDAR介导的钙信号。这些结果意味着,TwinF的神经保护活性并不是来源于对NMDARs或TRPM4通道的阻断。考虑到TwinF具有多个α-螺旋线,能够与两个苯基丙氨酸形成一个类似于口袋的结构【11】。将TwinF中的两个苯基丙氨酸都突变为丙氨酸后,作者发现,突变后的TwinF不能与复合物相互作用,也就是说,此时的TwinF不具有形成口袋结构活性;在体内,未突变TwinF和已突变TwinF存在相互竞争关系,影响TRPM4与NMDARs的结合;若破坏该复合物的结构,则表现出神经保护作用。
再进一步地,在NMDAR的两个亚基中,即GluN2A和GluN2B中,分别有一段为18个氨基酸的序列,该序列在鸟类和哺乳动物中是高度保守的,且两个序列中各含有4个分布规则的异亮氨酸,因此将该序列统称为I4, I为异亮氨酸的简写。作者发现,TwinF与I4中的I相互作用。换言之,复合物的形成,其实就是TwinF与I4的相互作用,从而使复合物具有毒性,而破坏这种相互作用,则可以起到神经保护作用。
至此,研究已揭示了NMDAR介导的神经毒性的来源,那么有何策略可以阻断或缓解这种毒性。因此下半部分研究旨在寻找破坏复合物结构、阻止毒性的小分子化合物。
目前来讲,通过重组腺相关病毒来向大脑立体定向递送目的基因片段的治疗方案不适合人类,于是作者想在理解该复合物结构学的基础上,来开发更为安全的治疗小分子。
在众多个能够与TwinF相互结合,进而来阻止复合物相互作用表面的化合物中,有两种小分子,简称C8和C19,具有明显的神经保护潜力。为了解释它们的神经保护活性,于是作者先观察了C8和C19可能对NMDAR诱导的钙信号的影响。细胞质钙离子成像、膜片钳技术等实验表明,两者都均不是NMDAR电流或NMDAR诱导的海马神经元钙信号的阻滞剂。但这不能排除其他的可能性,包括NMDARs的其他特性、其他可以准确评估小分子化合物和TwinF效果或作用的实验方法(即本研究中未采用的实验方法)等。
那么C8和C19对TRPM4通路的影响又如何呢?发现,C8和C19可以解毒NMDAR信号转导:阻断CREB关闭通路,恢复ERK1/2的激活和IEG的诱导表达、以及改善线粒体功能。CREB,即环腺苷单磷酸反应元件结合蛋白,此通路的关闭会导致转录异常,而转录异常与NMDAR介导的毒性有关;ERK1/2,即细胞外调节蛋白激酶1/2,该通路的不活跃或异常也与毒性有关;IEG,即直接性早期基因,如cFos、Bdnf、Npas4、Arc、Atf3等,IEG的诱导表达对于突触处NMDAR的激活是必要的。
最后,研究人员进行了模型体内验证试验,结果表明,C8和C19能够显著减少诱发缺血性脑卒中小鼠的脑损伤,并能够强烈阻止RGCs变性小鼠中由NMDAR导致的细胞死亡,RGCs即视网膜神经节细胞。
这下半部分实验表明,复合物相互作用表面抑制剂,比如C8和C19,均能够在体外体提供神经保护作用。
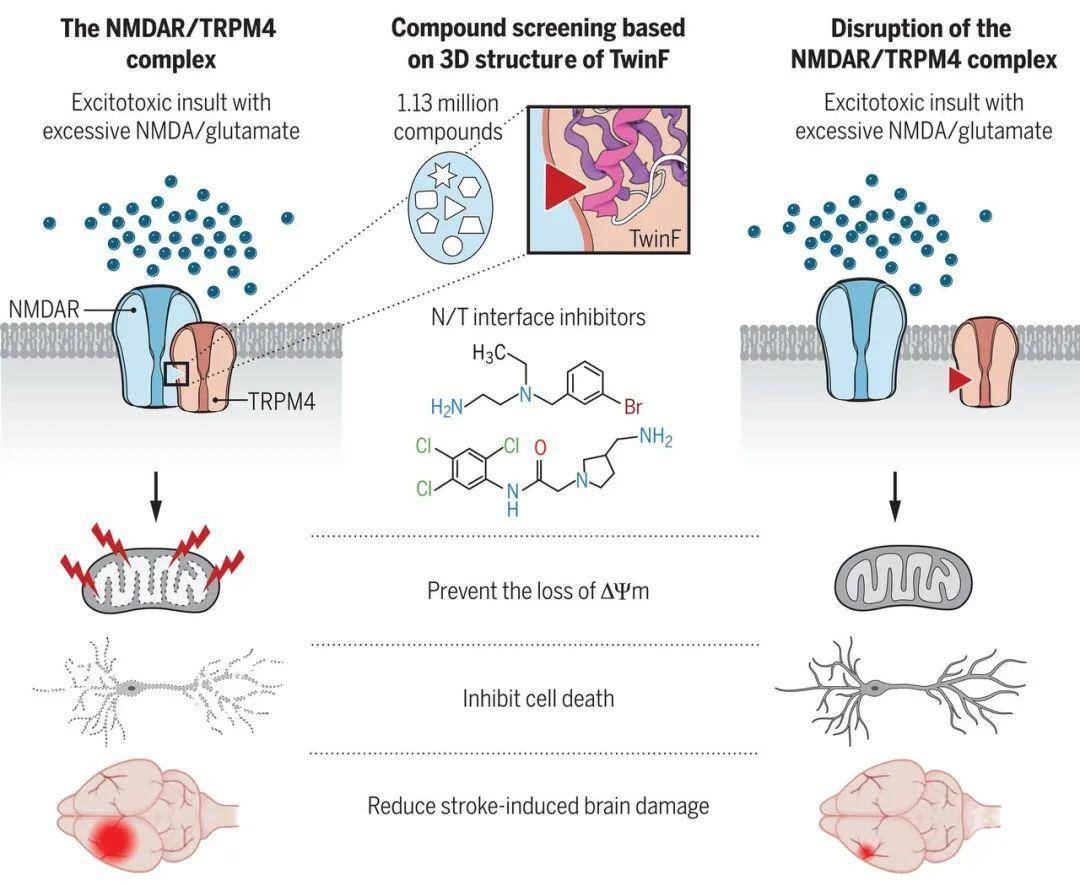
NMDAR/TRPM4复合物的形成对于兴奋性毒性是必要的(Δ Ψm即线粒体膜电位差)
(图片引自:J. Yan et al., Science 2020; 370, eaay3302)
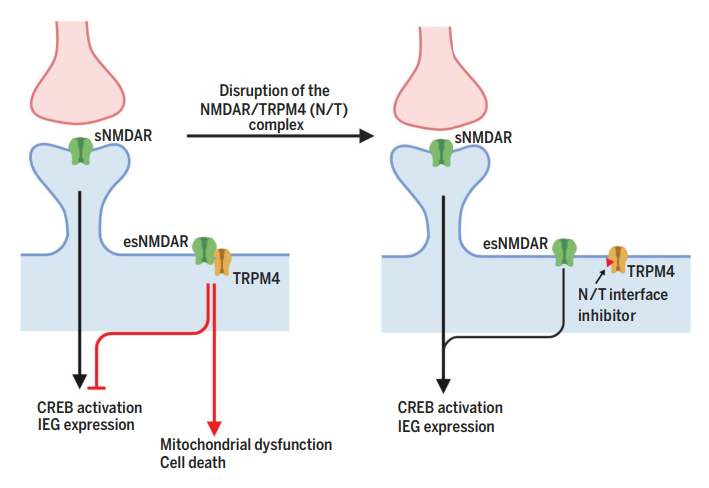
研究者提出的复合物相互作用界面抑制剂的神经保护作用模型图
(图片引自:J. Yan et al., Science 2020; 370, eaay3302)
文章结论
总的来说,该研究揭示了NMDAR介导的兴奋性毒性的来源,即NMDAR/TRPM4复合物,以及相互作用和介导毒性的具体结构域,进而解释了为什么突触外的NMDARs可以促进死亡信号。
该研究也发现了一类强有力的、且具有新作用模式的神经保护剂,即NMDAR/TRPM4相互作用界面抑制剂,如C8、C19。这类抑制剂可能是有效的、广泛适用的治疗方法。
研究也提示,直接靶向NMDAR信号,或是间接靶向NMDAR信号(比如TRPM4、或CREB、ERK1/2、以及IEG)将有助于许多神经疾病的病理研究和临床治疗,包括中风、创伤性脑损伤、阿尔茨海默病、亨廷顿病、肌萎缩性脊髓侧索硬化症和视网膜变性。
原文链接:
https://science.sciencemag.org/content/370/6513/eaay3302
参考文献
【1】P.Paoletti, C. Bellone, Q. Zhou, NMDA receptor subunit diversity: Impact on receptor properties, synaptic plasticity and disease. Nat. Rev. Neurosci. 14, 383–400 (2013).
【2】K. K. Ogden, S. F. Traynelis, New advances in NMDA receptor pharmacology. Trends Pharmacol. Sci. 32, 726–733(2011).
【3】H. Bading, Nuclear calcium signalling in the regulation of brain function. Nat. Rev. Neurosci. 14, 593–608 (2013).
【4】G. E. Hardingham, H. Bading, Synaptic versus extrasynaptic NMDA receptor signalling: Implications for neurodegenerative disorders. Nat. Rev. Neurosci. 11, 682–696 (2010).
【5】G. E. Hardingham, Y. Fukunaga, H. Bading, Extrasynaptic NMDARs oppose synaptic NMDARs by triggering CREB shut-off and cell death pathways. Nat. Neurosci. 5, 405–414 (2002).
【6】M. P. Parsons, L. A. Raymond, Extrasynaptic NMDA receptor involvement in central nervous system disorders. Neuron 82, 279–293 (2014)
【7】M. Aarts et al., A key role for TRPM7 channels in anoxic neuronal death. Cell 115, 863–877 (2003).
【8】B. Schattling et al., TRPM4 cation channel mediates axonal and neuronal degeneration in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 18, 1805–1811 (2012).
【9】P. Launay et al., TRPM4 is a Ca2+-activated nonselective cation channel mediating cell membrane depolarization. Cell 109, 397–407 (2002).
【10】J. Guo et al., Structures of the calcium-activated, non-selective cation channel TRPM4. Nature 552, 205–209 (2017).
【11】H. E. Autzen et al., Structure of the human TRPM4 ion channel in a lipid nanodisc. Science 359, 228–232 (2018).
来源:LT-Neuroscience 逻辑神经科学
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4Mjk3NzUxOQ==&mid=2247488013&idx=1&sn=d0bd01bde9db6d6d4271804171c7682d&chksm=eb90e78ddce76e9bde79a0bc0e99393f68ea2e84e99a5cc5b315f14a49bc4c18c99566ce3dc4#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
学习新任务时,大脑没有想象中那么灵活

生物材料Top10: 6. 光电转换纳米复合物—一条小鱼与神经疾病的故事

非视觉阻遏蛋白与GPCR复合物结构获解析

通知 || 首届糖复合物研究前沿网络大会
《科学》:揭示哺乳动物线粒体复合物I的作用机制
瘤内注射短寿命、高细胞毒性的钒(V)复合物治疗脑癌

简化蛋白质受体复合物研究的新方法
血清补体溶解免疫复合物活性

『主编手记』 不懈的动力
循环免疫复合物(CIC)