科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-06

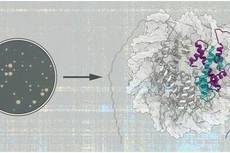
中国科学院上海药物研究所徐华强课题组、余学奎课题组和中国科学院生物化学与细胞生物学研究所国家蛋白质科学中心(上海)丛尧课题组合作,在G蛋白偶联受体(GPCR)跨膜信号转导领域获重大进展——首次解析了非视觉阻遏蛋白(Arrestin2)与神经降压素受体(NTSR1)复合物冷冻电镜结构,阐述了非视觉阻遏蛋白偶联多种不同特征GPCR进行信号整合的作用机制。研究成果近日在线发表于《细胞研究》。
GPCR作为人体最大的细胞膜受体蛋白家族,包含800多个成员,是超过1/3的临床及在研药物的作用靶标。GPCR主要通过偶联下游G蛋白和阻遏蛋白进行信号传导。阻遏蛋白包括视觉阻遏蛋白(Arrestin1和4)和非视觉阻遏蛋白(Arrestin2和3)。非视觉阻遏蛋白与GPCR复合物的结构研究一直都是GPCR领域的重点。但是,非视觉阻遏蛋白与GPCR的相互作用较弱,且组装的复合物具有高度柔性,给结构解析带来了很大挑战。
经过多轮筛选,研究人员确定以NTSR1为模式受体,并系统探究了增强Arrestin2和NTSR1相互作用、提高复合物稳定性的各种因素。这项研究最终获得了较为稳定的Arrestin2—NTSR1复合物,并解析了其冷冻电镜结构。
来源:中国科学报
来源:中国科学报
原文链接:http://news.sciencenet.cn//sbhtmlnews/2019/12/351767.shtm
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
循环免疫复合物(CIC)

膜内分子伴侣复合物协助膜蛋白的生物合成
Science:利用基因相互作用图谱确定蛋白复合物的整体结构

简化蛋白质受体复合物研究的新方法
非视觉阻遏蛋白与GPCR复合物的三维结构解析获进展
非视觉阻遏蛋白与GPCR复合物的三维结构成功获解析

人体毛发为何如此分布?或许是因为一种特殊蛋白
肠道寄生虫可以模仿人体产生蛋白来获取食物
血清补体溶解免疫复合物活性
循环免疫复合物(CIC)