科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-17
来源:iNature
在植物中,从头DNA甲基化的建立受RNA介导的DNA甲基化(RdDM)途径的调节。已知RdDM集中在Cajal体内,但是这种定位的生物学意义仍然难以捉摸。
2020年10月16日,中国科学院分子植物科学卓越创新中心/上海植物逆境生物学研究中心Rosa Lozano-Duran课题组在eLife 发表了题为“A virus-encoded protein suppresses methylation ofthe viral genome through its interaction with AGO4 in the Cajal body”的研究论文,该论文报道了植物病毒V2蛋白通过与宿主蛋白AGO4在Cajal 体内相互作用抑制宿主依赖于AGO4的DNA甲基化进而提高病毒毒力。该研究洞察了抗病防御、RNA介导的DNA甲基化(RdDM)途径和细胞核里的细胞器卡哈尔体三者之间的功能关系。
总之,该研究不但洞察了病毒与宿主博弈的新机制,而且阐明了在植物抗病防御过程中依赖于AGO4的RdDM 途径与Cajal体在功能上的关联。该研究成果为深入的探究宿主-病毒之间的互作,从而设计抗病策略、培育抗病作物提供了新思路。
另外,2020年8月24日,中国科学院分子植物卓越创新中心上海植物逆境生物学研究中心Rosa Lozano-Duran团队在Cell 在线发表题为“A Defense Pathway Linking Plasma Membrane and Chloroplasts and Co-opted by Pathogens”的研究论文,该研究显示了植物病毒编码的蛋白在激活植物防御后会从质膜重新定位到叶绿体,干扰叶绿体依赖性抗病毒水杨酸(SA)的生物合成。令人惊讶的是,该研究发现来自不同王国的植物病原体似乎与膜结合后趋向于进化为靶向叶绿体并削弱了SA依赖性防御,膜依赖于两个亚细胞靶向信号:N-肉豆蔻酰化位点和叶绿体转运肽。这种模式也存在于植物蛋白中,其中至少一种反过来激活了来自叶绿体的SA防御。综上所述,该研究结果表明植物中存在连接质膜与叶绿体并激活防御的途径,并且该途径已被植物病原体在宿主-病原体共同进化过程中所选择,以通过抑制SA反应来促进毒力。

胞嘧啶残基中的DNA甲基化是保守的表观遗传标记,对于保护真核基因组免受入侵的核酸(即病毒和转座因子)的侵害至关重要。在植物中,据信从头DNA甲基化的建立受RdDM途径的调节。规范的RdDM途径需要两种植物特异性RNA聚合酶II相关的酶Pol IV和Pol V,并以序列特异性的方式导致胞嘧啶甲基化。
简而言之,对RdDM的当前理解如下:Pol IV生成RNA转本,随后由RDR2转换为双链RNA(dsRNA),然后DCL3切成24nt siRNA;将产生的24-nt siRNA装入AGO4,通过序列互补性将其引导至Pol V产生的支架RNA分子,并募集从头甲基转移酶DRM2,其反过来催化相邻DNA序列的甲基化。RdDM通常会创建一个不影响基因表达的染色质环境。发现包括AGO4在内的部分RdDM机制集中在Cajal体中,Cajal体是核糖核蛋白复合物成熟的部位。该观察结果提示,Cajal体可能是AGO4 / NRPE1 / siRNA复合体装配的中心。然而,到目前为止,尚未证明RdDM成分的Cajal体定位以及该区域对于DNA甲基化的生物学相关性。
双生病毒是具有环状单链(ss)DNA基因组的植物病毒家族,可感染多种农作物并在全球范围内造成巨大的产量损失。在病毒繁殖过程中,ssDNA基因组会生成双链(ds)DNA中间体,然后进行滚环复制和依赖重组的复制。然而,迄今为止,病毒感染周期的这些基本初始步骤所必需的细胞和分子细节,包括病毒ss和ds DNA积累的亚核定位以及导致其产生的过程,至今仍是未知之数。
在双生病毒番茄黄叶卷曲病毒(TYLCV)感染期间,已显示必需的病毒编码蛋白V2抑制DNA甲基化。V2与本氏烟草中的组蛋白去乙酰基酶HDA6相互作用,与维持CG甲基转移酶MET1的募集竞争,并最终减少了病毒DNA甲基化。尽管如此,对HDA6的沉默导致病毒中V2无效突变的互补有限,并且病毒DNA甲基化仅部分减少,这表明V2可能通过与宿主因子的其他相互作用来对抗甲基化。
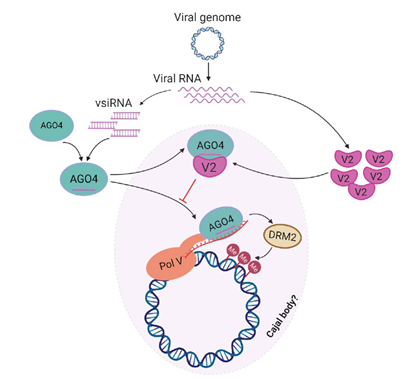
文章模式图(图源自eLife )
该研究发现植物病毒V2蛋白通过与宿主内RdDM途径中的关键组件AGO4蛋白特异的在Cajal体中相互作用进而抑制宿主对病毒基因组的甲基化修饰。通过基因沉默技术knock down烟草中的AGO4并开展了一系列功能分析,该研究论证了AGO4在宿主防御TYLCV中发挥作用且该过程被V2抑制。利用ChIP和RIP技术,本研究阐明了更进一步的分子机制:即V2通过干扰AGO4蛋白与病毒DNA或RNA的结合,从而达到保护病毒基因组免受甲基化的目的。
重要的是,通过沉默Cajal体中含量最丰富的组成蛋白coilin 进而阻止Cajal体的形成可以显著地减少 V2 无效突变的病毒基因组上的甲基化修饰,这表明,在没有 V2 的情况下,宿主对病毒基因组的甲基化修饰依赖于Cajal体的正常结构。该论文作者更深入的研究发现,V2 抑制DNA甲基化的活性需要其在Cajal体内的定位和其与 AGO4 在该细胞器内的互作,这也进一步支持了Cajal体在宿主对病毒基因组的甲基化修饰过程中扮演着重要角色且病毒蛋白V2可以抑制宿主依赖于该细胞器的对病毒基因组的甲基化。
综上所述,该研究不但洞察了病毒与宿主博弈的新机制,而且阐明了在植物抗病防御过程中依赖于AGO4的RdDM 途径与Cajal体在功能上的关联。该研究成果为深入的探究宿主-病毒之间的互作,从而设计抗病策略、培育抗病作物提供了新思路。
Rosa Lozano-Duran研究员为该论文通讯作者,博士后王立平为该论文第一作者,该项研究得到了中国科学院、国家自然科学基金的资助。
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247516269&idx=7&sn=9340196e04a663e6dd807dc924d49170&chksm=fce6f3b2cb917aa47f380b6a3c38a964383421d89ed7f92e532e7d0af0052e4488458bc12ac6&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
DNA甲基化跨代遗传研究取得进展
宋吉奎合作团队揭示DNA形变作为调节植物DNA甲基化的新机理

DNA到底能不能预测外貌?

DNA“甲基化指纹”鉴定出91种肿瘤
Nat Plants:植物如何防晒?抑制DNA甲基化
演化:“最奇怪动物”身份揭秘

Science:揭示蛋白QSER1保护DNA甲基化谷免受新生甲基化

肠癌血浆DNA甲基化检测——数字PCR技术

夫妻相真的存在,研究发现夫妻DNA相似度高过陌生人

当DNA甲基化遇上RNA甲基化:果实成熟的表观遗传调控