科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-06
来源:BioArt
近年来,作为一种主动的肿瘤免疫治疗策略,肿瘤治疗性疫苗引起的抗肿瘤细胞免疫反应在大多数情况下并不理想。产生肿瘤特异性的CD8 T细胞是疫苗发挥作用的关键所在,这个过程涉及对抗原输送到抗原呈递细胞(APC)的时空控制、抗原在抗原呈递细胞中的胞质输送及其交叉呈递。近年来,肿瘤纳米疫苗随着越来越多肿瘤新抗原的鉴定和纳米载体被开发的取得了长足的发展。开发更有效的肿瘤治疗性疫苗载体是肿瘤免疫治疗领域的当务之急。
2020年11月2日,来自苏州大学刘庄教授、彭睿教授和华东师范大学程义云教授等人在Nature Nanotechnology上在线发表了题目为“A general strategy towards personalized nanovaccines based on fluoropolymers for post-surgical cancer immunotherapy” 的研究成果,报道了一种基于氟化高分子(F13-PEI)个性化肿瘤疫苗的构建策略,用于术后肿瘤免疫治疗。经研究发现,F13-PEI与抗原组成的简单复合物不仅可以有效促进抗原在抗原递呈细胞中的胞质输送、显著增强对抗原的交叉呈递,还可以通过激活Toll 样受体4(TLR4)刺激产生细胞因子,从而显著增强该纳米疫苗的抗癌效应。

含氟烷基链既疏水又疏油,可同时提高阳离子高分子的血清稳定性、细胞摄入、内含体逃逸。此外,含氟高分子在水溶液中易自组装成纳米胶束或纳米聚集体,同时兼具阳离子高分子和脂质体类载体的优点。华东师范大学程义云教授课题组前期研究发现,利用含氟高分子优异的自组装性能以及其在胞外、胞内的独特理化性质可以将蛋白质分子与含氟高分子共组装形成高分子复合物,进而打破蛋白质胞内递送过程中存在的多重屏障,实现高效的蛋白质递送。
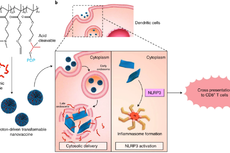
苏州大学功能纳米与软物质研究院刘庄教授课题组和彭睿教授课题组近些年基于生物材料与纳米医学技术,发展了新型肿瘤疫苗技术,探索了免疫联合治疗策略(如图二)。作者考虑到聚乙烯亚胺(PEI)虽然具有免疫刺激的佐剂作用但是其作为递送载体对细胞的毒性一直限制其被应用。他们推测氟化烷基链修饰的PEI(F-PEI)可能具有促进抗原胞质输送和免疫刺激的能力。
这种F-PEI与蛋白质抗原在30分钟内简单混合即可自组装成尺寸均一的纳米颗粒。在这个系统中,F-PEI可以有效地与抗原蛋白(OVA)结合,形成纳米复合物F-PEI/OVA。氟化程度更高的F13-PEI能显著增强DC对抗原(OVA)的摄取,并能高效地从内涵体逃逸进而更显著诱发抗原的交叉呈在无佐剂的情况下促进抗原呈递并刺激固有免疫反应纳米疫苗却不是很多,这也是目前纳米疫苗组分复杂和阻碍纳米疫苗实验临床转化的最主要原因。在本章工作中,我们发现在无佐剂的情况下,F-PEI可以通过激活TLR4和释放IL-1β细胞因子诱发DC细胞的成熟。
与细胞水平结果相似,注射了F13-PEI/OVA的小鼠体内淋巴结部位抗原呈递细胞不仅被活化,同时小鼠体内产生了更多的OVA特异性CD8+T细胞,小鼠体内产生的OVA特异性T细胞免疫反应会被激活并释放出IFN-。这也为构建预防型和治疗型疫苗(例如肿瘤疫苗和病毒疫苗)奠定了免疫学基础。
重要的是,与CpG和Alum等传统免疫佐剂相比,这种基于F-PEI的纳米疫苗在治疗B16-OVA黑色素瘤有更好的疗效,这可能是因为它的胞浆抗原递送能力促进了抗原交叉呈递,此外它还能够触发DC的激活。F-PEI通过利用氟烷链独特的疏水和疏油化学特性,将是一种独特的抗原载体和免疫佐剂,可用于构建预防和治疗型纳米疫苗。
利用F-PEI包裹肿瘤细胞膜的能力,将F13-PEI与切除肿瘤的癌细胞膜简单混合,即可制备出个性化的抗肿瘤疫苗。在两个皮下肿瘤模型和自发转移的原位肿瘤模型中证明,F13-PEI/Mem个体化纳米疫苗联合免疫检查点可以治疗无法完全切除的转移肿瘤。此外,在原位肿瘤模型中,我们观察到该联合策略具有强大的免疫记忆效应,可以有效地保护治愈的小鼠免受肿瘤的再次攻击。总体而言,这种基于F-PEI的个体化抗癌疫苗与免疫检查点疗法的协同作用在肿瘤术后的个体化免疫治疗临床转化中可能有很大的价值。
除了使用手术切除的肿瘤制造个性化的肿瘤疫苗外,肿瘤消融治疗(例如HIFU)后,将F13-PEI局部到注射到肿瘤中,显著抑制远端肿瘤的生长。除了本工作中展示的蛋白质疫苗和细胞膜疫苗外,这种基于F-PEI的载体还可用于核酸疫苗(例如mRNA疫苗)的开发。此外,除了抗癌疫苗之外,这种含氟聚合物还可以进一步扩展到制造其他类型的重要疫苗,例如针对病毒感染的疫苗(例如COVID-19)。
据悉,苏州大学功能纳米与软物质研究院刘庄教授、彭睿教授以及华东师范大学程义云教授为本文通讯作者,苏州大学功能纳米与软物质研究院徐骏为第一作者。华南理工大学博士后吕佳博士在该课题中做出重要贡献。庄齐、杨宗瑾等人参与共同研究。合作实验室包括苏州大学功能纳米与软物质研究院汪超课题组,苏州大学放射医学与防护学院杨凯课题组。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652506795&idx=6&sn=759b741a8b4edc0dfae5a267ec6e3738&chksm=84e1991fb3961009e2d484ada865ea66c951c30727e695547c39a50262fcb11bdc8db05689e1#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

肿瘤免疫治疗标志物的进展与思考
中国免疫学会2020肿瘤免疫与生物治疗年会暨首届肿瘤免疫治疗高级讲习班纪要



肿瘤免疫治疗,务必注意“超进展”!
可变形纳米递送系统增强肿瘤免疫治疗取得进展

用葡萄酒成分调控肿瘤免疫治疗

全新给药方式可降低癌症复发率
肿瘤营养不良患者细胞免疫治疗

肿瘤微环境与免疫治疗耐药的关系及应对

Nature Immunology综述 | 肿瘤免疫治疗抵抗的机制

肿瘤免疫治疗丨调节性T细胞及其应用