科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-10
来源:CBG资讯
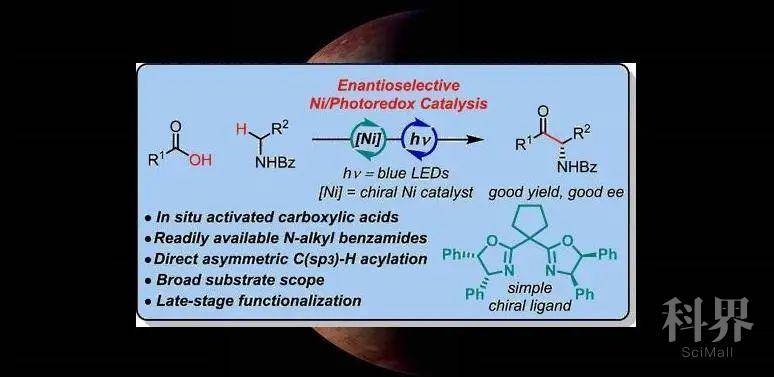
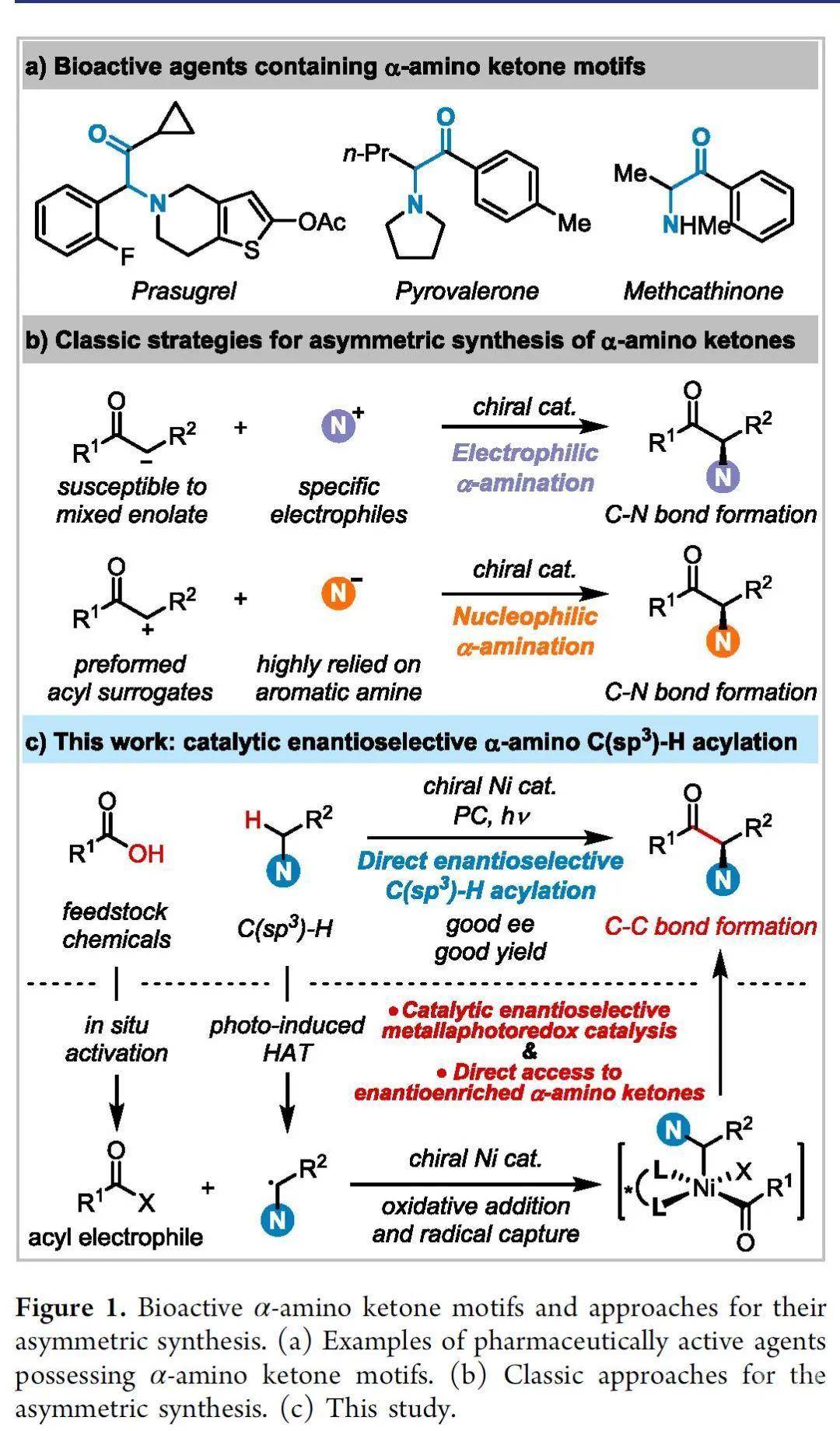
手性α-氨基酮是在许多重要的药物活性分子中的优势骨架(Figure 1a)。但是它的对映选择性合成仍然充满挑战。目前的合成报道高度依赖于羰基化合物的不对称亲电或亲核胺化反应。但这些方法通常需要特定的氨基化试剂或者繁琐的步骤来制备α-官能化的羰基化合物(Figure 1b)。近年来,过渡金属和光氧化还原双重催化方法已经成为构建化学键的有效工具。尽管研究人员在金属-光氧还原催化领域取得了一些进展,但其对映选择性的反应形式仍未得到充分探索,尤其是对于C(sp3)−H官能化而言。
近日,厦门大学霍浩华教授课题组首次报道了金属光氧化还原介导的对映选择性C(sp3)−H酰基化反应。该方法的原料简单,并合成了极具意义的手性α-氨基酮衍生物。相关研究成果发表在J. Am. Chem. Soc.上(DOI: 10.1021/jacs.0c10471)。
(图片来源:J. Am. Chem. Soc.)
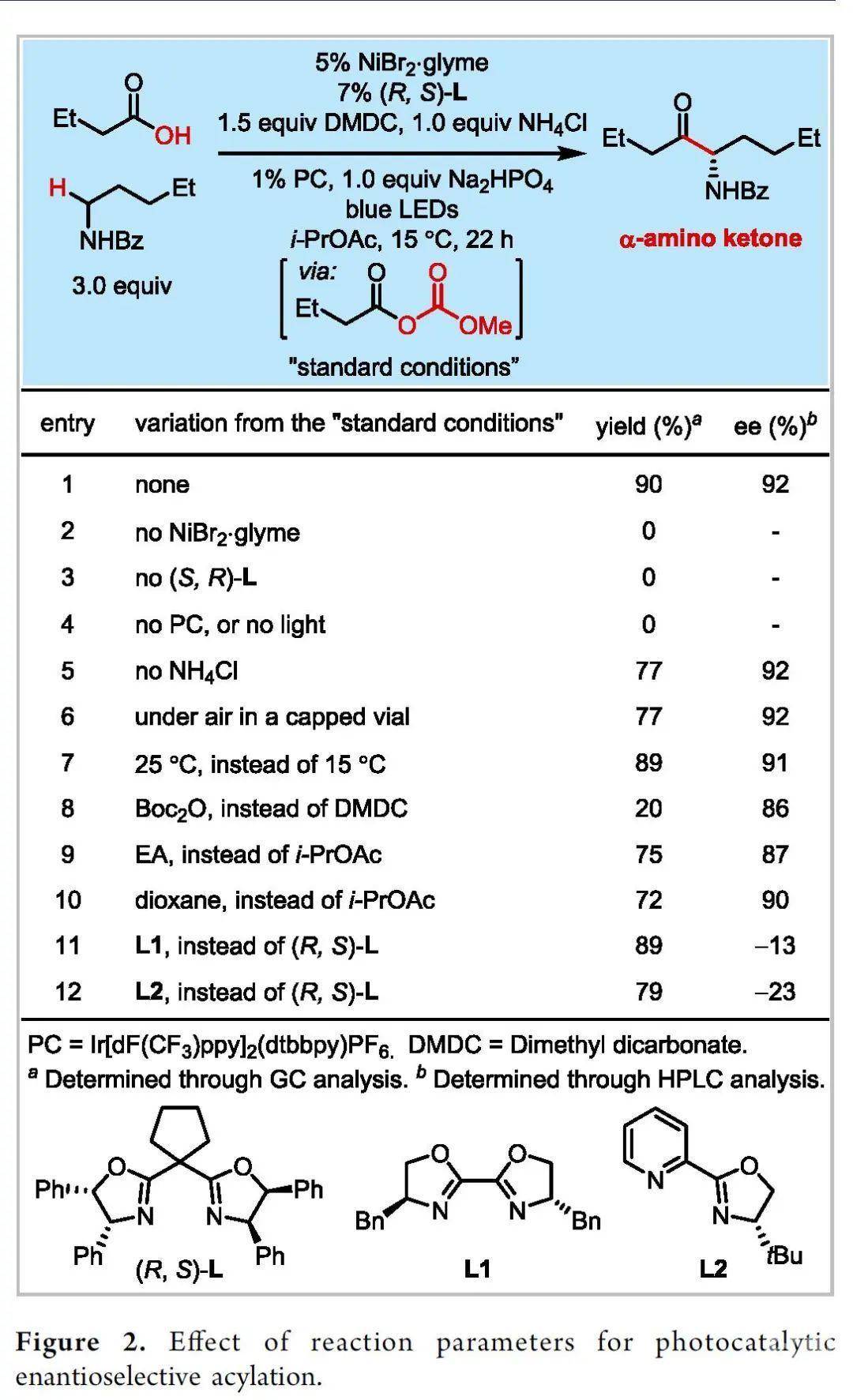
起初,作者首先对市售的丁酸和正戊基苯甲酰胺的交叉偶联反应进行条件优化(Figure 2)。通过大量的研究发现,以二碳酸二甲酯(DMDC)作活化剂,以手性镍/双噁唑啉和PCIr作催化剂,所需的酰基化反应以90%的收率和92%的ee值得到氨基酮产物(entry 1)。对照实验表明,镍、手性配体、光催化剂和光对产物形成至关重要(entries 2-4)。
(图片来源:J. Am. Chem. Soc.)
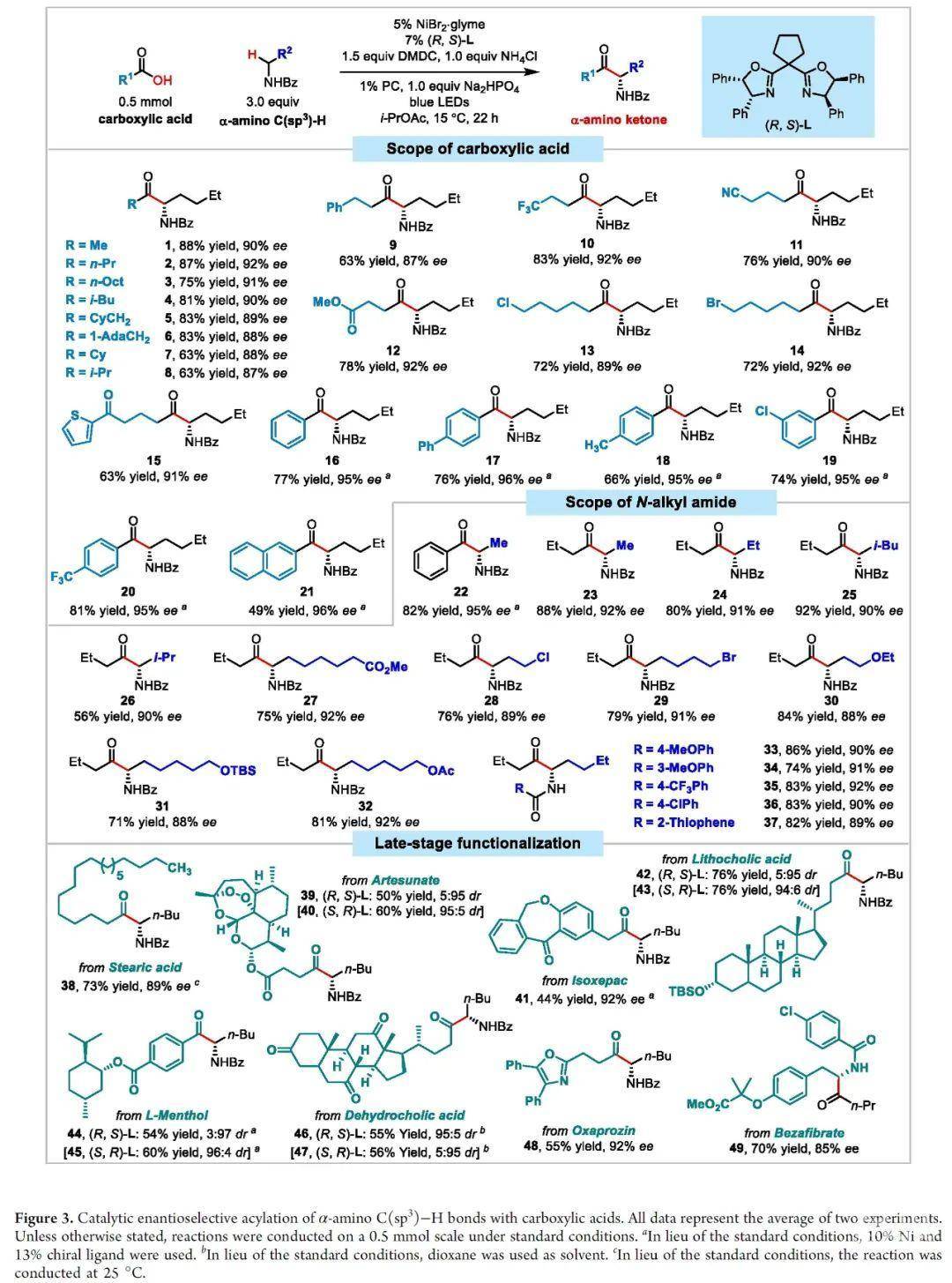
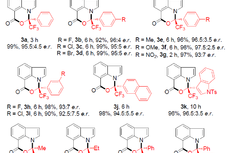
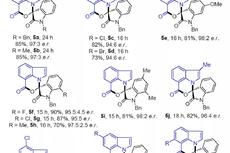
在优化的反应条件下,作者考察了底物的适用范围(Figure 3)。不同链长的羧酸都是合适的酰基供体,并且兼容各种官能团,包括(杂)芳基、腈基、酯基等。产物1-21具有良好的产率和优异的对映选择性。连有不同烷基侧链的胺同样适用于该酰化反应,以较高的收率和对映选择性生成22-37。多种官能团具有良好的相容性,例如酯、卤素、醚。随后,作者还将该策略应用于天然产物和药物分子的后期官能化。在温和的条件下,以良好的立体选择性制备了多种含有药效团或生物活性骨架的手性α-氨基酮38-49。
(图片来源:J. Am. Chem. Soc.)
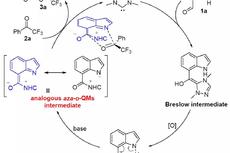
据机理研究和文献报道,作者提出了一个可能的反应机制(Figure 6)。该反应由Ni(0)中间体I与原位形成的酰基亲电试剂氧化加成得到Ni(II)中间体II引发。同时,氧化生成的溴自由基从α-氨基C-H键攫取氢原子形成了稳定的α-氨基自由基,其很容易被中间体II捕获。所得的Ni(III)中间体III经还原消除得到最终的偶联产物和Ni(I)中间体IV。随后,还原性的光催化剂对中间体IV进行单电子转移(SET)还原,使Ni(0)中间体I再生并完成催化循环。
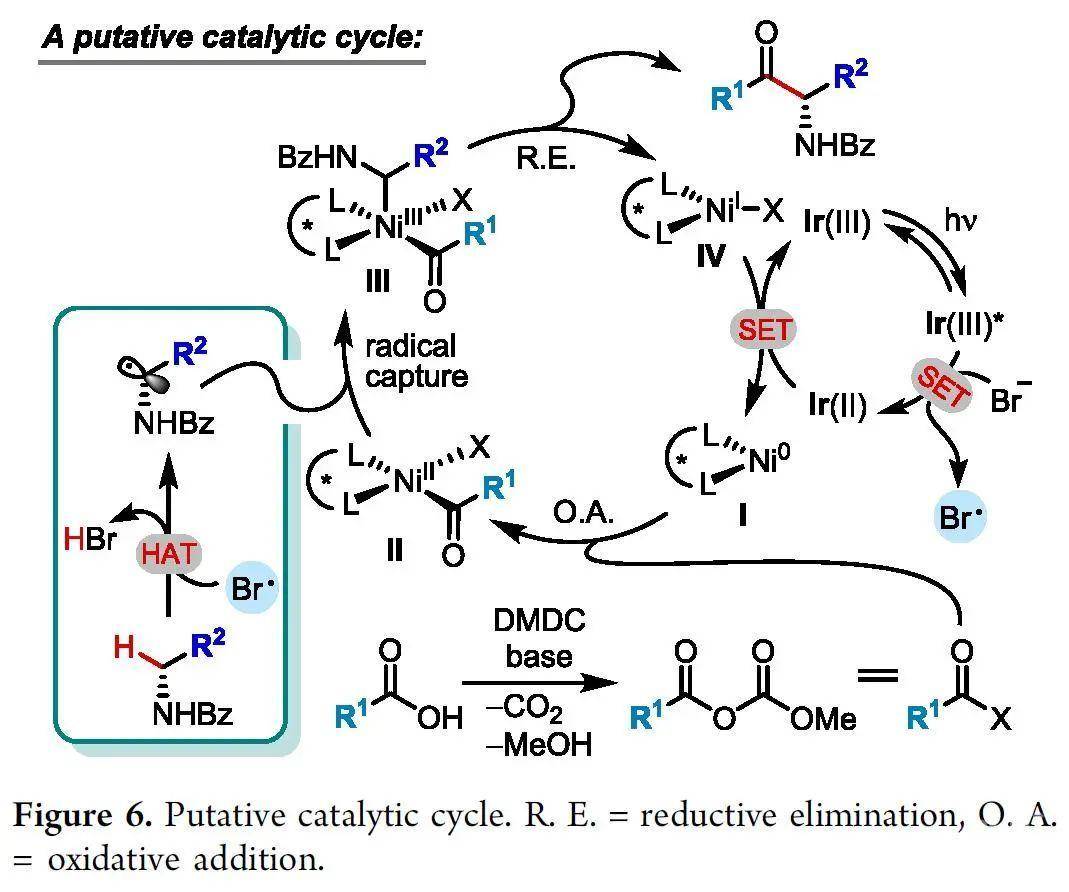
(图片来源:J. Am. Chem. Soc.)
总结:作者开发了金属-光氧化还原介导的对映选择性C(sp3)-H酰基化反应。该方法利用丰富、稳定的羧酸和易得的N-烷基苯甲酰胺作为偶联剂,具有相当宽的底物范围和优异的官能团耐受性,提供了直接获取重要的对映体α-氨基酮的途径。
来源:BeanGoNews CBG资讯
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247512903&idx=2&sn=d463269540eab18af904b073d7c7df41&chksm=ec3cb20edb4b3b18bacc4671883b7e46cb5a73a94334749b7e86b4ce881d61d8f06fda9103a6#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
从共价手性到拓扑手性:分子Solomon Links的立体选择性合成

2018未来科学大奖揭晓,袁隆平等7位科学家获奖

Angew: 具有手性季碳中心烯丙基砜结构的选择性构建

【每日科技速递】北京科技奖拟增“中关村奖”
合肥研究院在狄拉克半金属Cd3As2纳米片中观测到平面霍尔效应----中国科学院
西安光机所手性对映体选择性光学捕获研究获进展

果树所系统解析手性农药乙螨唑的立体选择性

选择性碳氢官能化促进的天然产物全合成及化学生物学研究领域连续取得重要进展
ACS Catal.:NHC对映选择性催化吲哚N-H的官能化反应
选择性腐蚀