科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-17
脑胶质瘤系发生于脑最常见的一类肿瘤。依其细胞构成不同又可分为星形母细胞瘤、星形细胞瘤、多形性胶质母细胞瘤、少突胶质细胞瘤、神经母细胞瘤、室管膜母细胞瘤、室管膜细胞瘤等。此类肿瘤生长部位、恶性程度不同。恶性脑胶质瘤是临床上常见的一类颅脑肿瘤,其发病率在颅脑肿瘤中高达60%。
定义颅内良性胶质瘤是指生长在颅内某一部位(多在脑神经组织外),细胞分化良好,生长缓慢,多能根治的肿瘤。而颅内恶性胶质瘤则相反(大都生长在脑神经组织内),细胞分化不良,生长迅速,难以根治。有些颅内良性肿瘤,由于位置深在,其周围有许多重要结构,发现时体积已很大,手术不能全部切除,预后不良。而有些部分的所谓颅内恶性肿瘤,由于生长在不很重要的脑组织中,几乎能全部切除,手术后也能生存较长时间,甚至能治愈。有极个别的脑瘤,开始为良性,以后转变成恶性。颅内胶质细胞瘤、转移瘤及侵入瘤多为恶性。恶性胶质瘤亦称脑癌,是生长于颅内的恶性肿瘤。
病因及常见疾病脑胶质瘤是由于大脑和脊髓胶质细胞癌变所产生的、最常见的原发性颅脑肿瘤,影响脑组织功能,早期可表现为刺激症状如局限性癫痫,后期表现为神经功能缺失症状如瘫痪,对人类健康事业造成巨大威胁。
鉴别诊断临床表现:主要为颅内压增高症状及相应部位的压迫症状,如头痛、呕吐、视力障碍、感觉障碍、偏瘫、语言障碍、共济失调等。诊断:CT、磁共振摄像有重要诊断意义,病理诊断方可确定其类型与性质。
检查根据现如今的WHO分型标准,胶质瘤被分为四种组织学等级。
胶质瘤Ⅰ级,例如毛细胞型星形细胞瘤是生长非常缓慢的肿瘤,若此型肿瘤得到完全切除,患者则有治愈的可能。
胶质瘤Ⅱ级(常见的有少突星形细胞瘤、星形细胞瘤等)。
侵袭性的Ⅲ级胶质瘤(间变性星形细胞瘤、间变性少突胶质细胞瘤等)处于中间临床病变过程。
Ⅳ级胶质瘤(恶性胶质瘤)则具有高度的侵袭性(中位生存期为14.5~16.6个月)。
治疗原则手术切除为本,有些易复发。脑胶质瘤主要以浸润性方式生长,扩散速度快,因此加重临床治疗困难,手术治疗的关键是切除肿瘤的同时延长患者生存期,但手术难以将其全部切除,复发性极高,因此,恶性脑质瘤术后联合化疗是极为重要的。
分级世界卫生组织将胶质瘤分为4级,恶性度从低度到高度。
1级为良性,2级为低度恶性,3级4级为高度恶性。
WHO一级胶质瘤(毛细胞性星形细胞瘤):手术是可以治愈性的。如果在术后影像上有残余肿瘤,则可行第二次手术切除整个肿瘤。放疗和化疗对此类肿瘤极其有限。
WHO二级胶质瘤(低度恶性胶质瘤):手术是非功能区肿瘤的最主要的治疗手段。对于40岁以下的肉眼全切的病人,无需额外的其他治疗。对于40以下的不全切除的肿瘤病人以及病人年龄大约40岁不管是否全切都应该进行放疗。
WHO三级胶质瘤(间变星形细胞瘤):需要手术来达到组织病理诊断和减小肿瘤体积。病人应当进行放疗和化疗。
WHO四级胶质瘤(多形性胶质母细胞瘤):同样需要手术来达到组织病理诊断和减小肿瘤体积。术后放疗(剂量在60Gy左右)。化疗手段包括卡莫司汀,联合方案PCV(甲基苄肼,环己亚硝脲和长春新碱),或者替莫唑胺用来对肿瘤生长进行控制。
分类星形细胞瘤为胶质瘤中最常见的一种,约占40%左右。病理分型为Ⅰ级(星形细胞瘤),Ⅱ级 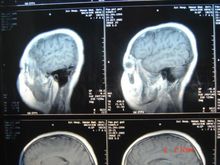 (星形母细胞瘤),Ⅲ~Ⅳ级(多形胶母细胞瘤)。Ⅰ~Ⅱ级星形细胞瘤为低度恶性,起病缓慢,肿瘤在CT及MR的表现多为实性或囊性,边界不清,肿瘤实性部分或囊性结节均可强化。临床表现与病灶部位不同进行性地出现相应的症状,并最后出现颅高压的症状。Ⅲ~Ⅳ级的多形胶母细胞瘤起病快速,为恶性度最高的肿瘤,多生长于大脑半球,因肿瘤生长迅速,肿瘤中心可有多处坏死及出血,CT及MR均明显强化。周围可伴大片脑组织的水肿。
(星形母细胞瘤),Ⅲ~Ⅳ级(多形胶母细胞瘤)。Ⅰ~Ⅱ级星形细胞瘤为低度恶性,起病缓慢,肿瘤在CT及MR的表现多为实性或囊性,边界不清,肿瘤实性部分或囊性结节均可强化。临床表现与病灶部位不同进行性地出现相应的症状,并最后出现颅高压的症状。Ⅲ~Ⅳ级的多形胶母细胞瘤起病快速,为恶性度最高的肿瘤,多生长于大脑半球,因肿瘤生长迅速,肿瘤中心可有多处坏死及出血,CT及MR均明显强化。周围可伴大片脑组织的水肿。
髓母细胞瘤为高度恶性肿瘤,好发于2-10岁的儿童,最少者可见于几月余小儿,大多数来源于小脑蚓部向四脑室及延髓小脑半球生长,以额、顶、颞叶区为多见。病人主要表现为神经功能障碍。常无法彻底手术切除,且复发迅速。因阻塞脑脊液循环通道,发现时多已伴有脑积水,CT及MR可发现后颅窝占位,因CT对此部位显示 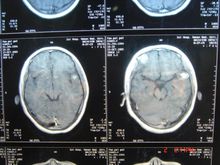 不清,故推荐MR检查。
不清,故推荐MR检查。
少枝胶质瘤为低度恶性肿瘤,偏良性,不少人亦称其为良性肿瘤。生长慢,瘤内常可见钙化斑块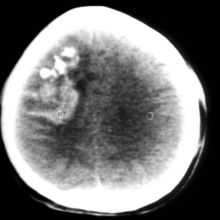
室管膜瘤亦为胶质瘤的一种,原则与星形细胞瘤基本相同。
脑胶质瘤大多缓慢发病,自出现症状至就诊时间一般为数周至数月,少数可达数年。恶性程度高的和后颅窝肿瘤病史较短,较良性的或位于静区的肿瘤病史较长。肿瘤若有出血或囊变,症状会突然加重,甚至有类似脑血管病的发病过程。胶质瘤的临床症状可分两方面,一是颅内压增高症状,如头痛、呕吐、视力减退、复视、精神症状等;另一是肿瘤压迫、浸润、破坏脑组织所产生的局灶症状,早期可表现为刺激症状如局限性癫痫,后期表现为神经功能缺失症状如瘫痪。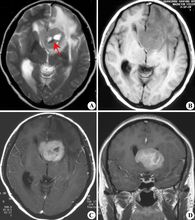
胚胎性肿瘤中枢神经系统 (CNS)包括恶性生殖细胞瘤、成神经管细胞瘤、原始神经外胚层肿瘤 (PNET)等 ,好发于儿童青少年
流行病学脑干肿瘤(脑干胶质瘤)占颅内肿瘤的1.4%。主要为神经胶质瘤,其中以星形细胞瘤和极性成胶质细胞瘤较为多见,其次是少枝胶质细胞瘤、室管膜胶质瘤、髓母细胞瘤,此外还可见到血管瘤(包括血管网织细胞瘤)、囊肿、畸胎瘤、结核瘤、转移性肿瘤等。儿童及青少年好发,特别是5~9岁儿童发病率最高。儿童病人常以分化较差的极性成胶质细胞瘤、髓母细胞瘤和室管膜瘤为多,成年病人则以星形细胞瘤为多。儿童患者病程短、进展快;常在较短时间(数周至数月)内即引起严重的脑干症状;成年患者病程长、进展慢,可数月甚至1年以上始出现严重的脑干症状。各种肿瘤在脑干中分布的部位略有不同,星形细胞瘤可分布于脑干的各部位,髓母细胞瘤和室管膜瘤则分布于导水管的被盖部位和第四脑室底。
脑干肿瘤(脑干胶质瘤)的症状可分为一般症状和局灶性症状两类。一般症状以后枕部头痛为常见。儿童常有性格改变,不少病人伴有排尿困难。颅内压增高常不是脑干肿瘤的首发症状。因此,对于进行性交叉性麻痹或多发性颅神经麻痹合并锥体束损害,无论有无颅内压增高均应首先考虑脑干肿瘤的可能。脑干肿瘤的局灶性症状随肿瘤的部位而异,由于肿瘤的浸润性生长,明确划分具体部位如中脑或桥脑实际上是困难的。
症状脑干肿瘤(脑干胶质瘤)症状:
中脑肿瘤由于肿瘤极易阻塞导水管,故早期可出现颅内压增高症状。也有首发症状为精神和智力改变,这可能与网状结构受累有关。根据肿瘤侵袭部位不同,常表现有:①动眼神经交叉性偏瘫综合症——Weber综合症,病变位于大脑脚底部,出现病侧动眼神经麻痹,对侧上、下肢体和面、舌肌中枢性瘫痪。②四叠体综合症——Parrnaud综合症,表现眼睑下垂、上视麻痹、瞳孔固定、对光反应消失、会聚不能等。③Benedikt综合症,表现为耳聋等、病侧动眼神经麻痹、对侧肢体肌张力增强、震颤等。
桥脑肿瘤占全部脑干肿瘤半数以上,多见于儿童。早期儿童常以复视、易跌跤为首发症状;成年人则常以眩晕、共济失调为首发症状。90%以上病人有颅神经麻痹症状,约40%病人以外展神经麻痹为首发症状,随着肿瘤发展出现面神经、三叉神经等颅神经损害和肢体的运动感觉障碍。常表现有Millard-Gubler综合症——桥脑半侧损害,包括面神经交叉瘫,若病变位于桥脑下半部偏一侧时致病侧周围性面瘫伴对侧肢体偏瘫。
延髓肿瘤首发症状常为呕吐,易被误诊为神经性呕吐或神经官能症,特别是成年患者。病人可有不同程度头昏、头痛,然后较早出现后组颅神经麻痹的症状,如吞咽困难、进食呛咳、讲话鼻音、伸舌不能等。肿瘤累及双侧时则出于真性延髓麻痹症群,同时伴有双侧肢体运动、感觉障碍及程度不等的痉挛性截瘫,病程早期可有呼吸不规则,晚期可出现呼吸困难或衰竭。
临床上常表现的延髓半侧损害有:①舌下神经交叉瘫(Jackson综合症);②吞咽、迷走交叉瘫(Avellis综合症);③Schmidt综合症——病侧Ⅸ~Ⅶ颅神经麻痹及对侧半身偏瘫;④延髓背外侧综合症(Wallenberg综合症)等。
诊断胶质瘤的诊断,根据其生物学特征、年龄、性别、好发部位及临床过程进行分析,在病史及体征基础上,采用电生理、超声波、放射性核素、放射学及核磁共振等辅助检查,定位正确率几乎是100%,定性诊断正确率可在90%以上。
脑胶质瘤由于肿瘤呈浸润性生长,与脑组织无明确分界,难以彻底切除,手术治疗的原则是在保存神经功能的前提下尽可能切除肿瘤。早期肿瘤较小又位于适当部位者可争取全部切除。位于额叶的肿瘤,可作脑叶切除。当额叶或颞叶肿瘤范围较广不能全部切除时,可同时切除额极或颞极作内减压术。肿瘤位于运动、言语区而无明显偏瘫、失语者,宜注意保存神经功能,适当切除肿瘤,避免发生严重后遗症。脑室肿瘤宜从非功能区切开脑组织进入脑室,尽可能切除肿瘤,解除脑梗阻。位于丘脑、脑干的胶质瘤,除小的结节性或囊性者可作切除外,一般作分流术,缓解增高的颅内压后,进行中医药综合治疗。
脑胶质瘤的特点及治疗现状胶质细胞瘤的生长特点为浸润性生长,与正常脑组织无明显界限,多数不限于一个脑叶,向脑组织外呈指状深入破坏脑组织,偏良性者生长缓慢,病程较长,恶性者瘤体生长快,病程短。
国内外对于胶质瘤的治疗普遍为手术、中医药、放疗、化疗、X刀、和γ刀。
胶质瘤手术手术治疗基于胶质瘤的生长特点,理论上手术不可能完全切除,生长在脑干等重要部位的肿瘤有的则根本不能手术,所以手术的治疗目的只能局限于以下5个方面①明确病理诊断,②减少肿瘤体积降低肿瘤细胞数量,③改善症状缓解高颅压症状;④延长生命并为随后的其他综合治疗创造时机;⑤获得肿瘤细胞动力学资料,为寻找有效治疗提供依据。依据生长位置及生长特点,约50%无法全切,为了避免手术后功能损害,即使为全切术,在原发部位仍会有肿瘤残存,所以很难根治,复发率很高。根据我院长时间的,随访和调查胶质瘤3、4级复发最快的一个月左右,慢的多半年。
1、2级一般的复发1-2年。
胶质瘤放疗放射治疗几乎是各型胶质瘤的常规治疗,但疗效评价不一,除髓母细胞瘤对放疗高度敏感,室管膜瘤中度敏感外,其他类型对放疗均不敏感,有观察认为放疗与非放疗者预后相同。此外射线引起的放射性坏死对于脑功能的影响亦不可低估。X-刀、γ-刀—均属放射治疗范畴,因肿瘤的部位、瘤体大小(一般限于3厘米以下)及瘤体对射线的敏感程度,治疗范畴局限,认为胶质瘤,特别是性质恶性的星形Ⅲ-Ⅳ级或胶质母细胞瘤均不适合采用R-刀治疗。
胶质瘤化疗原则上用于恶性肿瘤,但化疗药物限于血脑屏障及药物的毒副作用,疗效尚不肯定,常用治疗的脑胶质瘤几种西药有效率均在30%以下。
化疗方案恶性胶质瘤并不是一个均一的群体,同种病理类型不同病人对同一化疗方案的疗效不一样,胶质瘤中某些遗传特征的改变与其对化疗的敏感性密切相关。如何识别出化疗有效人群,对提高化疗疗效,避免盲目/无效化疗具有重要意义。比较肯定与临床疗效相关的分子有:O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase , MGMT)和染色体1p/19q杂合性缺失(loss of heterozygosity, LOH)。在化疗前先检测肿瘤组织中MGMT和染色体1p/19q的表达,据检测结果选择化疗方案有望提高化疗的有效性。
据MGMT表达不同指导的恶性胶质瘤个体化化疗(1) MGMT强阳性(++)和阳性(+)表达患者化疗方案
这类患者由于存在由MGMT介导的耐药因素,不宜用亚硝脲类药物单药或TMZ五天方案化疗。可选用不含亚硝脲和TMZ的化疗方案,如VM26+DDP;亚硝脲类药物或TMZ联合其他药物化疗,DDP在亚硝脲类药物或TMZ给药前24小时给予可降低MGMT转录;由于TMZ有自身耗竭MGMT的作用,可选用TMZ较长时间持续用药方案。
(2) MGMT可疑阳性(±)和阴性(-)表达患者化疗方案:
这类患者选择化疗药物的范围相对比较广,可结合年龄、卡氏评分、病理级别、肿瘤组织中其他分子指标如PCNA、PTEN、TOPOII、GST等的表达,选用亚硝脲类或替莫唑胺单药或与其他药物联合用药方案,也可选用不含亚硝脲类或替莫唑胺方案。
杂合性缺失与少突胶质瘤治疗方案选择染色体1p/19q杂合性缺失的少突胶质瘤患者对化疗敏感,预后好,生存期长,手术后先行PCV方案或TMZ组成的方案化疗,放疗可推迟,作为复发时的挽救治疗。单1p LOH的少突胶质瘤患者也对化疗敏感,但化疗疗效持续时间及生存期相对短,需放化疗结合治疗,手术后可先行化疗,化疗结束后尽快行放疗。1p/19q均无LOH,尤其伴有PTEN突变、10q LOH、EGFR扩增、CDKN2A 缺失和环状强化的患者预后非常差,建议6周同期放化疗,然后序贯周期化疗。
分子靶向药物治疗用于胶质瘤化疗临床研究的分子靶向药物较多。常用的有靶向血小板衍生的生长因子受体(platelet-derived growth factor receptor , PDGFR)的小分子酪氨酸激酶抑制剂伊马替尼(imatinib)、靶向表皮生长因子受体(epidermal growth factor receptor, EGFR)的小分子酪氨酸激酶抑制剂吉非替尼(gefitinib)、靶向血管内皮生长因子(vascular endothelial growth factor, VEGF)的重组人单克隆IgG1抗体贝伐单抗(Bevacizumab)等。
由于信号传导通路的复杂性以及不同通路之间的交互作用,单一靶向药物治疗恶性胶质瘤作用有限。针对多个靶点的药物,或有互补作用的不同靶向药物的联合,靶向药物和细胞毒类药物如替莫唑胺,以及放疗的联合治疗将是提高疗效的关键。
早期恶性胶质瘤能治好吗就治疗现状而言,恶性脑瘤仍是医学上未被攻克的一大难题,但是这也并不等于得了恶性胶质瘤就被宣判了死刑,临床上亦有不少治疗后长期生存的病例。 早期恶性胶质瘤能治好吗?主要取决于是否及时采取了恰当的治疗手段。早期恶性脑瘤癌肿较小,若部位合适,应行手术切除。若癌肿部位切除难度大,可先行放疗,待癌肿变小后,再行手术切除。另外,西医各治疗手段均会对人体正常细胞造成不同程度的损伤,临床上多主张联合中医药治疗,以起到增效减毒的作用。
本词条内容贡献者为:
赵辰生 - 副主任医师 - 山西省心血管病医院 神内