科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-27
11月12日,国家蛋白质科学研究(上海)设施用户中国农业大学赵广华教授研究团队在纳米材料领域著名期刊ACS Nano杂志上在线发表了题为“His-Mediated Reversible Self-Assembly of Ferritin Nanocages through Two Different Switches for Encapsulation of Cargo Molecules”的研究论文,定向设计笼形蛋白可逆自组装并将其应用于药物分子的包埋。
笼形蛋白广泛存在于自然界中,在生命体中扮演者重要的角色。铁储藏蛋白(ferritin)是一种典型的笼形蛋白,其通过亚基界面之间的复杂而精确作用自组装形成二十四聚体笼形结构。其中人源铁储藏蛋白的可逆自组装以及特异性识别人肿瘤细胞的特性被广泛用于抗肿瘤药的靶向输送与治疗。但是通过传统酸碱变性方法利用铁储藏蛋白包埋活性分子存在蛋白变性损失大,以及包埋效率低的问题。
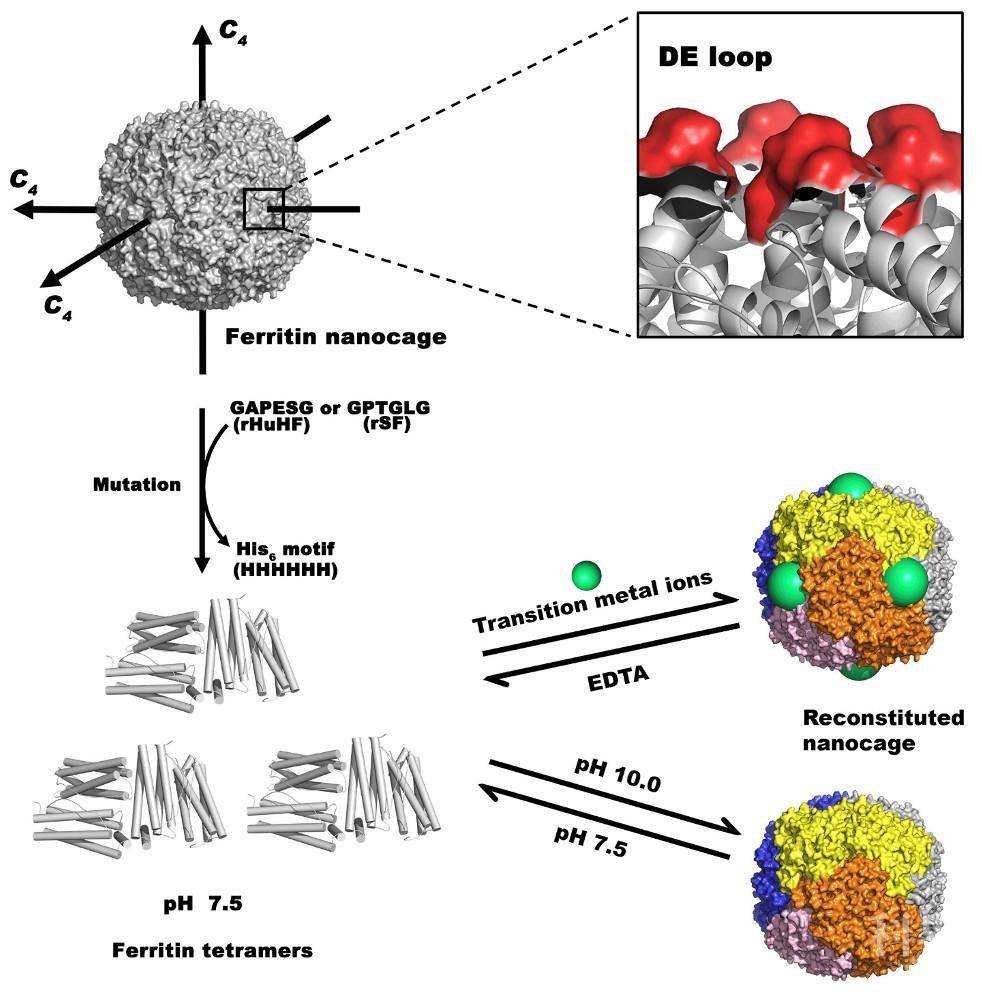
图1. 铁蛋白两种可逆自组装策略
赵广华教授研究团队长期致力于笼形蛋白分子的分子内以及分子间自组装机制研究,在笼形蛋白分子定向改造及其可逆自组装机理研究领域取得了一系列重要研究成果。为了提高铁储藏蛋白的包埋效率,在该研究中该研究团队提出将组氨酸结构域插入到铁储藏蛋白C4对称轴的思想,利用蛋白质对称轴中组氨酸结构域在接近中性条件下存在静电斥力,成功制备得到在近中性pH值(7.5)条件下由4个亚基组成的铁储藏蛋白突变体,由于过渡金属离子(镍、铜以及锌)可以与蛋白质中组氨酸的特异性配位, 所以在接近中性条件下过渡元素可以诱导其重新自组装成由24个亚基组成的球状蛋白,加入螯合剂后,笼形蛋白又可解离成四聚体(图 1);通过X射线晶体衍射方法揭示了突变体分子内组装的结构信息,金属离子在铁储藏蛋白的四重轴处通过与组氨酸的配位作用(图 2)将四聚体重新组装为笼形结构,阐明了将四聚体铁储藏蛋白突变体重新组装为正常铁储藏蛋白的笼形结构的分子机制。

图2. (a) 铁蛋白突变体晶体堆积方式. (b) Ni离子通过组氨酸配位稳定铁蛋白四重轴通道. (c,d) Ni离子与组氨酸配位环境.
另外,利用组氨酸结构域在pH 10.0左右不带电荷的特点,将溶液pH调到10.0也可以诱导该四聚体蛋白形成笼形蛋白分子,将pH调回7.5,又可解离成由4个亚基组成的蛋白。通过利用上述四聚体突变体的可逆自组装性质,建立了一种新型的对姜黄素以及阿霉素等生物活性药物小分子的包埋方法,且包埋效率分别提高到传统酸变性包埋的4.8及3.4倍。
国家蛋白质科学研究(上海)设施BL18U1线站及BL19U1线站,上海光源BL17U1线站工作人员为该工作提供了及时有效的支持。
(蛋白质设施上海提供)
来源:中国科学院重大科技基础设施共享服务平台
原文链接:http://lssf.cas.cn/lssf/dbzkxyjshss/xwdt/202011/t20201127_4559047.html
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Nat Chem Biol :邹贻龙博士等揭示细胞铁死亡过程中的重要执行蛋白

恐龙时代火山灰催生页岩油气储藏
王友军教授课题组在Nature子刊上发表文章阐述STIM1蛋白激活的分子机制
中科院科学家研究揭示玉米籽粒中储藏蛋白从胚乳向胚重分配的分子调控机制

月球表面或储藏着数百万吨冰

浙江大学发现铁调蛋白抵御细菌感染新机制
PBJ:遗传发育所张爱民团队在小麦储藏蛋白表达调控上取得进展
深圳先进院利用溶液法实现复杂氧化物大面积外延薄膜生长
肠道寄生虫可以模仿人体产生蛋白来获取食物
Au(III) 从溶液装载到去铁铁蛋白笼的完整运输路径