科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-30
来源:BioArt
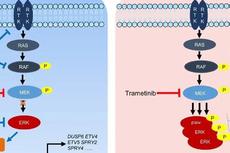
效应性T细胞的枯竭是免疫治疗的限速步骤,通过一些小分子抑制分子突破这一限速步骤则是免疫治疗领域研究的重点之一【1】。丝裂原活化蛋白激酶(mitogen-activated protein kinase,简称MAPK)信号通路可以调控细胞分化,新陈代谢以及活化状态【2,3】。近些年来,T细胞代谢,活化和衰竭之间相互联系机制的研究,已成为癌症病人免疫治疗的重要靶点之一【4】。在肿瘤微环境(Tumor microenvironment,简称TME)中,持续的丝裂原活化可以诱导效应性细胞的过量分裂和消耗,从而减弱其行使功能和免疫记忆的能力【5】。有报道指出,MEK抑制剂(MEK inhibition,简称MEKi)具有抗肿瘤的作用,并且,其抗肿瘤作用很可能是通过其增强肿瘤的免疫原性(tumor immunogenicity)和调节TME所实现的【6-9】。然而,MEKi对T细胞功能行使,分化成熟以及免疫记忆等方面的作用,仍旧不得而知。
2020年11月23日,来自美国乔治敦大学的Samir N. Khleif 研究组在Nature Immunology上发表题为MEK inhibition reprograms CD8+ T lymphocytes into memory stem cells with potent antitumor effects的研究文章,发现MEKi可以将CD8+T淋巴细胞诱导成为具有抗肿瘤功能的记忆性干细胞。

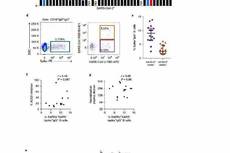
首先,作者采用两种小鼠肿瘤模型,抗原分别为TC-1 (HPV16E7) 和B16F10 (gp100) ,并引入其对应疫苗。作者还选取selumetinib(AZD6244, ARRY-142886)这一MEK1/2抑制剂作为研究对象。发现, 在这两种模型中,MEKi都可以有效的增强其疫苗介导的抗肿瘤作用。并且,在MEKi的作用下,总的和抗原依赖的CD8+T细胞水平都有了显著提高,而且,大部分抗原依赖的CD8+T细胞都表达颗粒酶B(granzyme B),这说明MEKi可以提高TME中功能性的抗原特异性效应细胞的增殖。另外,在这些T细胞中,表达有抑制性受体(如CTLA4, LAG3,TIM3)的T细胞水平降低,而表达活化性分子(如CXCR3,IL-2Rβ,OX40)的水平升高。上述结果都说明,MEKi可以TME中效应性CD8+T细胞的浸润,并且在维持T细胞活化和防止其枯竭方面起到积极的作用。
接下来,作者研究MEKi是通过何种机制起到影响CD8+T细胞的作用的。因为调控细胞代谢是Ras–Raf–MAPK 通路的重要作用之一,所以,作者首先关注MEKi对T细胞代谢的影响。作者发现,MEKi可以显著提高线粒体的呼吸作用,生物合成和脂肪酸代谢,而对糖类代谢影响不大。并且,MEKi的这些功能,是通过增加PGC1α和促进 SIRT3和以FAO为基础的细胞呼吸作用实现的。
因为高水平的细胞代谢和FAO与免疫记忆相关,所以再下来,作者研究在TME中,MEKi与免疫记忆的关系。作者发现,在MEKi作用下的CD8+T细胞中,与免疫记忆争相相关的CCR7水平上升,而负向相关的KLRG1水平降低。另外,Sca1+CD62L+CD44- 和TMRMlo CD62L+CD44- CD8+ T 细胞水平和作为干细胞特征标签的IL-2Rβ水平也明显上升。这些结果说明,MEKi具有提高TME中干细胞样记忆性CD8+T细胞(stem cell–like memory,简称 TSCM )水平的作用。
再下来,作者研究MEKi是通过何种机制诱导TSCM的。作者发现,只有原初态的CD8+T细胞(naïve CD8+T)可以诱导为TSCM,而活化状态的则不行。另外,MEKi可以抑制细胞增殖和cyclinD1的表达水平,并且,在CD8+T细胞的细胞周期早期阶段起到抑制性作用。而且,MEKi的这两项作用,增强细胞代谢和抑制细胞周期,在CD8+T细胞诱导成为TSCM过程中都具有关键性作用。
最后,报道指出,TSCM具有显著的召回效应(recall response),而这一效应在抗肿瘤治疗中起到至关重要的作用。作者采用过继性免疫疗法(adoptive cell therapy,简称ACT)肿瘤模型,发现MEKi作用下的CD8+T细胞,起召回效应水平是正常细胞的5倍之多,其肿瘤治疗效果,也得到了明显的提升。
综上所述,作者发现,MEKi可以通过抑制CD8+T细胞的细胞周期,增强线粒体生物合成和脂肪酸代谢等机制来诱导TSCM。并且,MEKi所诱导出的干细胞样记忆性CD8+T细胞,在肿瘤的免疫治疗中起到积极的作用。
原文来源:
https://doi.org/10.1038/s41590-020-00818-9
参考文献
1. Lim, W. A. & June, C. H. The principles of engineering immune cells to treat cancer. Cell 168, 724–740 (2017).
2. Carr, E. L. et al. Glutamine uptake and metabolism are coordinately regulated by ERK/MAPK during T lymphocyte activation. J. Immunol. 185, 1037–1044 (2010).
3. Terada, Y. et al. Regulation of cyclin D1 expression and cell cycle progression by mitogen-activated protein kinase cascade. Kidney Int. 56, 1258–1261 (1999).
4. Pearce, E. L., Poffenberger, M. C., Chang, C. H. & Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science 342, 1242454 (2013).
5. Scharping, N. E. et al. The tumor microenvironment represses T cell mitochondrial biogenesis to drive intratumoral T cell metabolic insufficiency and dysfunction. Immunity 45, 701–703 (2016).
6. Ebert, P. J. R. et al. MAP kinase inhibition promotes T cell and anti-tumor activity in combination with PD-L1 checkpoint blockade. Immunity 44, 609–621 (2016).
7. Hu-Lieskovan, S. et al. Improved antitumor activity of immunotherapy with BRAF and MEK inhibitors in BRAF(V600E) melanoma. Sci. Transl. Med. 7, 279ra41 (2015).
8. McCubrey, J. A. et al. Mutations and deregulation of Ras/Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR cascades which alter therapy response. Oncotarget 3, 954–987 (2012).
9. Kono, M. et al. Role of the mitogen-activated protein kinase signaling pathway in the regulation of human melanocytic antigen expression. Mol. Cancer Res. 4, 779–792 (2006).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652511830&idx=6&sn=ef48cf0ffe8911c0319be839f3f289e6
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
淋巴细胞毒试验
关于有记忆性T淋巴细胞的研究
《科学》子刊:老药新用!MEK抑制剂有望治疗遗传性PAX6单倍剂量不足
谭静团队揭示增强子重编程介导MEK抑制剂治疗晚期卵巢癌的耐药机理
淋巴细胞数

周荣斌团队《NatImmunol》发文报道肠道共生病毒维持肠道粘膜免疫稳态的作用和机制

天然淋巴细胞骨髓外发育路径获揭示
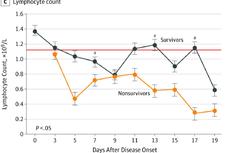
JAMA最新:武汉中南医院分析了138例新冠肺炎患者,这些药物没有明显作用!
如何预防“人体卫士”T淋巴细胞癌变
淋巴细胞系统