孙熙宸
加好友
孙熙宸 2019-12-09
来源:BioArt
免疫系统中固有免疫细胞表达模式识别受体(Pattern-recognition receptors PRRs)用来感知微生物来源的模式分子(Microbe-associated molecular patterns MAMPs)。机体把这些MAMPs定义为“非我成分”。PRRs的各个成员之间存在差异性,各司其职。然而有时微生物来源的核酸与宿主来源的核酸在生化结构上具有相似性。机体在区分自我与非我的过程中,同时引入其他机制。例如PRRs的表达位置,一些PRRs会定位在不可能出现自身来源的配体的地方,如溶酶体;核酸酶会调控内源性核酸的含量;又或者通过干扰素等其他信号调节核酸识别的阈值【1】。
人体中识别核酸的PRRs包括TLR3、7、8、9四个。TLR3识别双链长链RNA-dsRNA;TLR7和TLR8识别RNA降解后的产物;TLR9能够识别含有CpG的DNA。在小鼠中还会表达能够识别核酸的TLR13,TLR13不同于其他识别核酸的TLRs,它能够识别具有特殊序列和构象的单链RNA【2】。人TLR8在髓系来源的细胞中表达量较高,在B细胞和pDC等细胞中则不表达。尽管小鼠和人的TLR8表达谱类似,但功能不同。人的TLR7和TLR8则具有类似的激活结构模式。在TLR7或者TLR8组成的同源二聚体中,受体中的LLR结构域能够形成左右对称的结构。在形成的这种构象中,存在两个与配体结合的位点,位于二聚体表面顶端部位。TLR8中这个位置可以与尿苷酸结合或者TLR8的激动剂。在LRR结构域的凹面则还有另外两个结合位点,能够与短链核苷酸结合。LRR底部的结构域的结合能够增强顶部结合位点对尿苷酸的亲和力。存在高浓度的尿苷酸时,TLR8与配体结合则不需要底部结合位点的激活【3】。尽管对TLR8的结构的已知,但是在复杂的RNA识别系统中,TLR8的配体是如何形成的还未知。
近日,来自德国慕尼黑路德维希-马克西米利安斯大学的Thomas Carell和Veit Hornung课题组合作在Cell上发表了题为TLR8 Is a Sensor of RNase T2 Degradation Products的文章。该文章报道发现溶酶体中的核糖核苷酸酶RNase T2能够在单链RNA嘌呤和尿苷酸之间切开,这一分解代谢反应为TLR8提供了LRR结构域顶部和底部结合配体。

首先作者选用了BLaER1单核细胞进行研究,这种细胞转分化之后TLR8能够明显高表达【4】。之后对从HIV-1基因组分离出的一种20聚体单链寡核酸RNA ---RNA40这种TLR8的经典配体进行改造。作者通过硫代磷酸修饰而稳定RNA40,并将这种变体称为RNA40S。改造后的RNA40S半衰期更长。作者用聚阳离子多肽聚L-精氨酸(pR)将RNA送入溶酶体。检测发现RNA40S完全依赖于TLR8在BLaER1单核细胞中诱导促炎因子产生。作者由此利用此模型进行下一步探索。作者提出假设认为RNA40降解为能够与TLR8结合的配体这一过程需要核糖核酸酶。作者将目标锁定在人原代单核细胞和转分化后的BLaER1单核细胞中都有高表达的RNASE2 RNASE6和RNASET2,还有在BLaER1中高表达的RNASE1。利用一系列的相关的敲除或者表达恢复实验最终发现RNase T2是RNA激活TLR8必需的。作者利用液相色谱和多种类型的寡核苷酸来鉴定RNase T2的切割模式。最后发现RNase T2能够剪切发生在单链RNA中嘌呤和尿苷酸之间,剪切之后形成尿苷酸和腺苷2,3-环磷酸酯激活TLR8。并且这种TLR8配体的产生完全依赖于RNase T2参与的分解反应。细致一点分析发现如果直接给予细胞被RNase T2剪切后的RNA产物则能够弥补RNase T2缺失造成的TLR8激活缺失。
为了求证RNase T2在TLR8识别病原微生物中的重要作用,作者利用了金黄色葡萄球菌感染模型。之前的报道发现人髓系来源的细胞主要通过TLR8来识别金黄色葡萄球菌。无论是用金葡来源的RNA或者活菌共培养都发现这些条件下细胞产生促炎因子都依赖于RNase T2和TLR8。同时作者用同位素标记的金葡菌也得到了一致的结果,并且发现金葡产生寡链核糖核苷酸不依赖于RNase T2。
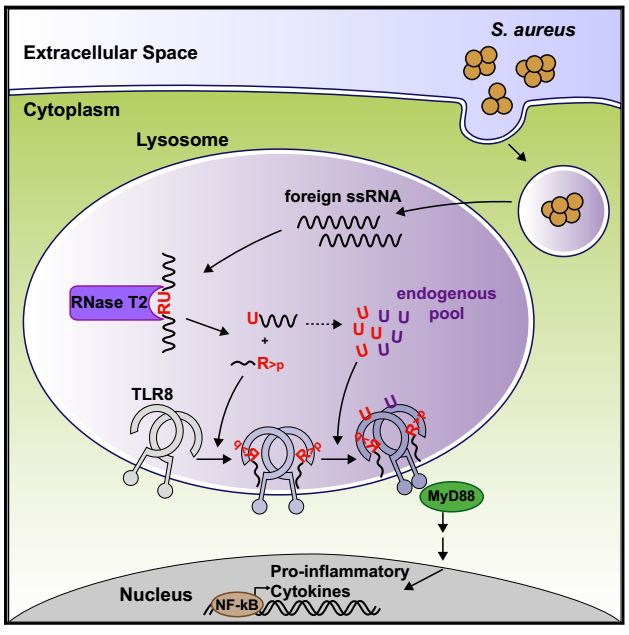
这一研究也表明不同种类以及不同部位的RNA被不同的PRR感应,不同部位PRR受关键分子状态又会相互影响。如果溶酶体中的RNA不能够被有效降解,累积转移至细胞浆中,则会启动细胞浆识别RNA系统。这也提示RNase T2的活性会影响RNase T2作为TLR8介导的促炎反应的上游关键分子和作为RNA降解酶而发挥抗炎作用这二种角色之间的平衡。
原文链接:
https://doi.org/10.1016/j.cell.2019.11.001
参考文献
1. Wu J, Chen ZJ. Innate immune sensing and signaling of cytosolic nucleic acids. Annual review of immunology 2014; 32: 461-488; doi 10.1146/annurev-immunol-032713-120156.
2. Song W, Wang J, Han Z, Zhang Y, Zhang H, Wang W et al. Structural basis for specific recognition of single-stranded RNA by Toll-like receptor 13. Nature structural & molecular biology 2015; 22(10): 782-787; doi 10.1038/nsmb.3080.
3. Tanji H, Ohto U, Shibata T, Taoka M, Yamauchi Y, Isobe T et al. Toll-like receptor 8 senses degradation products of single-stranded RNA. Nature structural & molecular biology 2015; 22(2): 109-115; doi 10.1038/nsmb.2943.
4. Gaidt MM, Ebert TS, Chauhan D, Schmidt T, Schmid-Burgk JL, Rapino F et al. Human Monocytes Engage an Alternative Inflammasome Pathway. Immunity 2016; 44(4): 833-846; doi 10.1016/j.immuni.2016.01.012.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478712&idx=6&sn=620e72bbc8f667cd7c036eb3aea9fe2a&chksm=84e20f4cb395865a472f2d674fb4a8dfab4b677cc75e4ddf8ad51e11f614e163e4c6f477a199&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
《细胞》发文!阿片类药物迎来重大突破
Nature Biotechnology:13种单细胞RNA测序方法的比较
微型RNA调控眼睛干细胞生物过程

揭秘细胞外RNA

人体细胞内存在“铁路”系统,能自动优化结构
分子细胞卓越中心发现长非编码RNA对细胞核仁结构和RNA聚合酶I转录的调控机制

单细胞RNA测序揭示治疗诱导的人类肺癌进化

人工细胞与生物细胞首次实现成功融合与协作

学术造假必遭严惩,为何仍不断有人冒险
Science:构建出人类跨组织单核RNA测序细胞图谱