科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-08
来源:BioArt
责编 | 兮
小鼠胚胎干细胞具有发育的多能性,可以产生除滋养外胚层之外其他所有成体细胞类型【1】,因此在发育潜能上与受精卵、2细胞期胚胎等早期胚胎细胞的全能性存在差别。近些年来发现小鼠胚胎干细胞中有小比例的细胞会自发激活2细胞期的特异转座元件MERVL,并具有小鼠2细胞期合子基因组激活(ZGA)的转录谱特征,因此这种细胞被定义为2C-like细胞,具有全能性的特征【2】。这一转换过程被广泛作为体外研究全能性和ZGA的模型【3-6】。
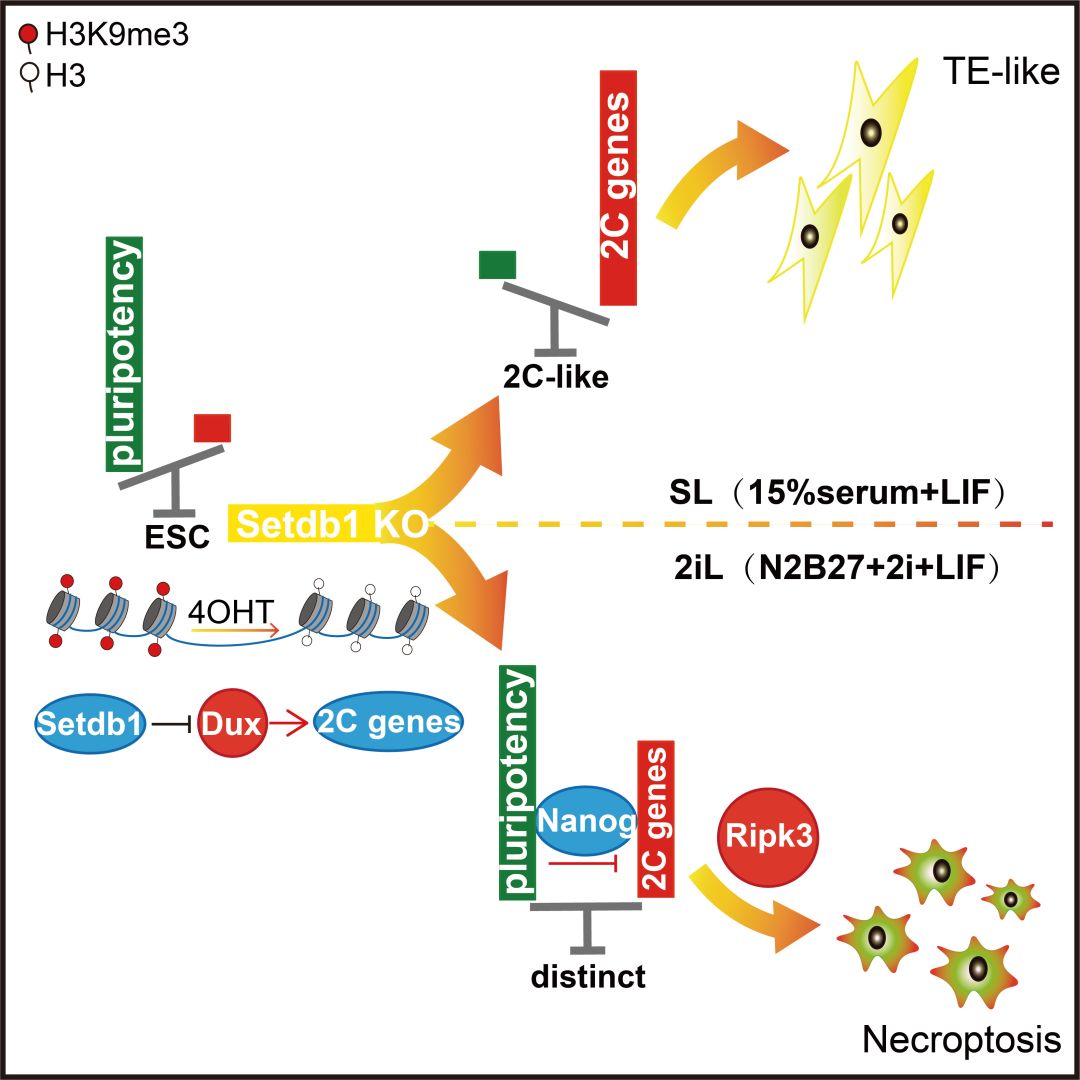
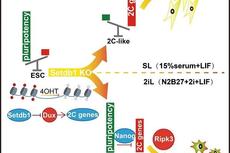
2020年1月7日,中国科学院广州生物医药与健康研究院陈捷凯研究组在Cell Reports在线发表题为SETDB1-mediated Cell Fate Transition Between 2C-like and Pluripotent States的研究论文。该研究发现了H3K9甲基化酶SETDB1在全能性重编程中的作用,其敲除可促进多能性向全能性转换,且在ground state培养条件下Setdb1敲除会引起程序性坏死。该结果阐释了Setdb1介导的H3K9甲基化对多能性建立以及胚胎干细胞存活的重要作用,进一步支持了SETDB1在早期胚胎发育过程中的重要地位。

该研究主要的内容如下:
1. 确定Setdb1介导的H3K9me3在全能性向多能性发育过程中的重要性。
同济大学高绍荣团队早前发现,早期胚胎从2C发育到ICM的过程中H3K9me3的重建起着重要作用,其直接参与了转座元件LTR的抑制以及转录抑制(详见BioArt报道:NCB丨高绍荣、张勇合作组揭示胚胎发育异染色质修饰的重编程过程——沈立点评)【7】。在已知的H3K9me3甲基化酶中,Setdb1的缺失是致死表型出现最早的,会造成囊胚发育缺陷【8】。这一工作发现在多能性状态下敲除Setdb1,细胞启动2C阶段的转录程序,说明Setdb1在多能性状态下扮演了全能性的限制器作用。结合其他研究结果,可以确定Setdb1介导的H3K9me3在全能性向多能性发育过程中的重要性。
2. 对Setdb1的功能作出完整的阐述
之前研究显示在胚胎干细胞中敲除Setdb1会导致滋养外胚层分化,但滋养外胚层的一些关键因子如Cdx2附近并没有Setdb1介导的H3K9me3,因此这一过程的分子机制并不清晰。本研究中发现在胚胎干细胞中,基因组上可比对的序列上的H3K9me3基本都是由Setdb1所催化的,并与Setdb1敲除后的基因激活呈显著相关,其中就包括Dux的激活。尽管Dux对胚胎发育过程中的ZGA并非必须的(专家点评Nature Genetics | 张毅团队证明体内DUX并非小鼠胚胎基因组激活的关键因子;Cell Research丨高绍荣团队全面描绘DUX在小鼠胚胎基因组激活中的作用)【9】,但多个研究表明其对从多能干细胞诱导到2C-like状态是必须的【4-6,10,11】,本研究中通过Dux敲除的方法阻碍了Setdb1敲除引发的2C-like转换,在这一条件下也无法观察到滋养外胚层的分化标志物,说明Setdb1敲除并不是直接导致滋养外胚层产生,而是通过产生具有全能性的2C-like细胞再获得分化为滋养外胚层的潜能的。
另一方面,科学家在2C-like转换的模型上做了许多筛选,由于已知同是H3K9甲基化酶G9a以及与Setdb1相互作用沉默逆转录元件因子Kap1都被报导抑制2C-like转换【12】,其中Setdb1主要抑制I型和II型逆转录元件(MERVL属于III型)【13】,所以这些研究都有重点比较过Setdb1的作用,但都得到阴性结果【12,14,15】,所以本领域之前倾向于认为Setdb1可能未在全能性到多能性的分化过程中扮演重要角色,这也导致对该发育过程重要表观遗传标记H3K9me3的执行者存在疑惑。本研究通过详细比较这些研究过程,发现这些阴性结果都是采用RNA干扰策略且敲降效率未优化的方法所得到的,只有通过敲除或加强敲降效率(如两轮转染siRNA),才可以观察到Setdb1缺失后引发的2C-like程序。这说明Setdb1的功能是剂量敏感的,也将之前相关的研究间的不一致统一起来,从而较全面的总结阐明了Setdb1在多能性调控中的功能。
3. 发现在“ground state”状态下Setdb1的调控功能
本研究是从比较经典培养方法(SL, serum+LIF)和ground state培养方法(2iL,pD0325901+chir99021+LIF)中Setdb1的功能差异开始的,也因此发现Setdb1敲除后在两个系统中都引发2C-like程序,而只在经典方法中诱导滋养外胚层分化。通过探索这其中的差异,本研究发现了前面所提的一些内容。Ground state状态是抑制2C-like转变的,但原因并不清楚。在本研究中对这个问题给出了两方面探索,第一方面,由于ground state阻碍多能性蛋白在2C-like转换中的去除,本研究发现过表达Nanog也可以完全阻止Setdb1敲除导致的2C-like转换;另一方面,在Ground state的培养状态下,敲除Setdb1会导致细胞启动RIPK3依赖性的程序性坏死,导致细胞迅速死亡。
原文链接:
https://doi.org/10.1016/j.celrep.2019.12.010
参考文献
1. Beddington RS, Robertson EJ. An assessment of the developmental potential of embryonic stem cells in the midgestation mouse embryo. Development. 1989;105(4):733-7.
2. Macfarlan TS, Gifford WD, Driscoll S, Lettieri K, Rowe HM, Bonanomi D, et al. Embryonic stem cell potency fluctuates with endogenous retrovirus activity. Nature. 2012;487(7405):57-63.
3. Choi YJ, Lin CP, Risso D, Chen S, Kim TA, Tan MH, et al. Deficiency of microRNA miR-34a expands cell fate potential in pluripotent stem cells. Science. 2017;355(6325).
4. Eckersley-Maslin M, Alda-Catalinas C, Blotenburg M, Kreibich E, Krueger C, Reik W. Dppa2 and Dppa4 directly regulate the Dux-driven zygotic transcriptional program. Genes Dev. 2019;33(3-4):194-208.
5. Rodriguez-Terrones D, Gaume X, Ishiuchi T, Weiss A, Kopp A, Kruse K, et al. A molecular roadmap for the emergence of early-embryonic-like cells in culture. Nat Genet. 2018;50(1):106-19.
6. Yan YL, Zhang C, Hao J, Wang XL, Ming J, Mi L, et al. DPPA2/4 and SUMO E3 ligase PIAS4 opposingly regulate zygotic transcriptional program. PLoS Biol. 2019;17(6):e3000324.
7. Wang C, Liu X, Gao Y, Yang L, Li C, Liu W, et al. Reprogramming of H3K9me3-dependent heterochromatin during mammalian embryo development. Nat Cell Biol. 2018;20(5):620-31.
8. Dodge JE, Kang YK, Beppu H, Lei H, Li E. Histone H3-K9 methyltransferase ESET is essential for early development. Mol Cell Biol. 2004;24(6):2478-86.
9. Chen Z, Zhang Y. Loss of DUX causes minor defects in zygotic genome activation and is compatible with mouse development. Nat Genet. 2019;51(6):947-51.
10. Cossec JC, Theurillat I, Chica C, Bua Aguin S, Gaume X, Andrieux A, et al. SUMO Safeguards Somatic and Pluripotent Cell Identities by Enforcing Distinct Chromatin States. Cell Stem Cell. 2018;23(5):742-57 e8.
11. Percharde M, Lin CJ, Yin Y, Guan J, Peixoto GA, Bulut-Karslioglu A, et al. A LINE1-Nucleolin Partnership Regulates Early Development and ESC Identity. Cell. 2018;174(2):391-405 e19.
12. Maksakova IA, Thompson PJ, Goyal P, Jones SJ, Singh PB, Karimi MM, et al. Distinct roles of KAP1, HP1 and G9a/GLP in silencing of the two-cell-specific retrotransposon MERVL in mouse ES cells. Epigenetics Chromatin. 2013;6(1):15.
13. Matsui T, Leung D, Miyashita H, Maksakova IA, Miyachi H, Kimura H, et al. Proviral silencing in embryonic stem cells requires the histone methyltransferase ESET. Nature. 2010;464(7290):927-31.
14. Li P, Wang L, Bennett BD, Wang J, Li J, Qin Y, et al. Rif1 promotes a repressive chromatin state to safeguard against endogenous retrovirus activation. Nucleic Acids Res. 2017;45(22):12723-38.
15. He J, Fu X, Zhang M, He F, Li W, Abdul MM, et al. Transposable elements are regulated by context-specific patterns of chromatin marks in mouse embryonic stem cells. Nat Commun. 2019;10(1):34.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479735&idx=4&sn=3e7ec6022e5b3f4dac9269f23dfc6105&chksm=84e23343b395ba555a2fd35f18ac0b8f199a722e76f1bcc86c7709afa0de11431d3ea811c88e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

邹卫国团队发现组蛋白去甲基化酶LSD1对于骨折愈合至关重要

科学家研究揭示H3K27me3去甲基化酶KDM6家族调控人神经发生的关键作用
研究发现衣藻中去甲基化酶CMD1催化以维生素C为底物的5mC去甲基化修饰机制

Plant Cell:拟南芥组蛋白去甲基化酶JMJ28调控开花的分子机制
华中农大揭示组蛋白去甲基化酶参与水稻能量稳态调节表观遗传学机制
曹晓风研究组在植物组蛋白去甲基化酶的招募机制研究中取得新进展
减数分裂细胞中组蛋白去甲基化酶底物特异性

中山大学张锐团队发现了新型的mRNA m5C甲基化酶

研究发现衣藻中去甲基化酶CMD1催化以维生素C为底物的5mC去甲基化修饰
研究发现H3K9甲基化酶SETDB1在多能性-全能性转换中的作用