科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-12
来源:BioArt
快速增殖的细胞,包括大多数的癌细胞在内,优先选择糖酵解产生乳酸的途径,而不是线粒体氧化磷酸化途径来获得ATP能量,这种现象被称为Warburg 效应。Warburg效应促进癌细胞增殖的作用主要体现在三个方面:1)糖酵解能快速地为细胞提供ATP;2)糖酵解的中间代谢物能作为其它生物大分子合成的前体;3)糖酵解能减少细胞的氧化自由基浓度,维持氧化还原平衡【1, 2】。然而癌细胞是如何通过调控葡萄糖代谢途径来促进其恶性增殖行为的分子机制目前还并不清楚。
在糖酵解途径中,约2-5%的葡萄糖会经由支路已糖胺途径(HBP)生成UDP-乙酰氨基葡糖胺(UDP-GlcNAc),用于在蛋白质的丝氨酸或苏氨酸残基上进行糖基化修饰(O-GlcNAc)。该糖基化修饰广泛存在于细胞质、线粒体、以及细胞核内的蛋白上,是一种动态可逆的蛋白修饰【3】。之前的研究表明O-GlcNAc糖基化在许多不同类型的肿瘤中都具有异常的高表达,并在癌细胞的恶性增殖中发挥着重要作用,然而其中的原因和相关的分子机制还未得到充分的揭示【4】。
2020年1月7日,浙江大学生命科学学院易文课题组在Nature Communications杂志在线发表了题为O-GlcNAcylation of PGK1 coordinates glycolysis and TCA cycle topromote tumor growth的研究论文,揭示了O-GlcNAc糖基化通过调控糖酵解关键代谢酶PGK1的功能来促进肿瘤的生长的分子机制。

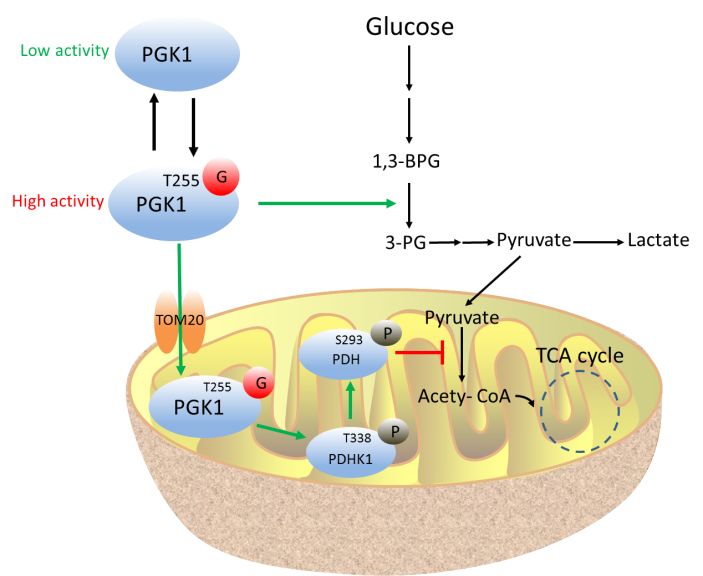
磷酸甘油酸激酶1(phosphoglycerate kinase 1,PGK1)是糖酵解途径中的关键代谢酶,它催化1,3-二磷酸甘油酸(1,3-BPG)转化为3-磷酸甘油酸(3-PG)并产生糖酵解途径中的第一个ATP。PGK1在多种癌细胞中有高水平的表达;最近的研究表明,PGK1与肿瘤的发生和发展密切相关。PGK1 在多个位点上发生磷酸化和乙酰化,在特定条件下会发生线粒体和细胞核的易位,直接或间接地增强糖酵解活性,促进癌细胞的增殖和生长【5-9】。然而,是否PGK1存在糖基化还有待证实;另外,其糖基化的功能目前没有相关的报道。
该研究首先发现,敲低PGK1基因后,结肠癌细胞的糖酵解能力被显著削弱,进而导致细胞的增殖和成瘤能力也受到抑制,说明PGK1对结肠肿瘤发生的必要性。之后研究者通过化学生物学手段证实PGK1具有O-GlcNAc糖基化修饰;进而通过高分辨质谱结合点突变的生化方法鉴定出PGK1上关键的糖修饰位点T255,并证实该位点的糖基化能显著增强PGK1的代谢酶活性。同时,研究者发现,T255位点的糖基化也能诱导PGK1发生线粒体易位,PGK1在线粒体中并发挥蛋白激酶作用,对丙酮酸脱氢酶激酶1(PDHK1)进行磷酸化,进而抑制TCA循环。进一步发现T255的糖基化与之前报道的S203磷酸化对PGK1发生线粒体易位的诱导作用相互独立,T255的糖基化会促进PGK1与线粒体膜蛋白TOM20的相互作用,而这种作用并不受到S203位点磷酸化的影响。靶向代谢组学实验也证实了PGK1糖基化促进糖酵解通路和丝氨酸合成通路,而抑制TCA循环代谢。小鼠体内成瘤实验和临床样本分析也进一步验证了PGK1的糖基化修饰对结肠癌生长的促进作用。
综上所述,这项研究揭示了PGK1 O-GlcNAc糖基化修饰的两方面功能:1)糖基化修饰上调PGK1的代谢酶活性,增强糖酵解作用;2)糖基化修饰诱导PGK1发生线粒体易位,进而抑制TCA循环代谢。这两种功能的叠加能增强癌细胞的Warburg 效应,从而促进肿瘤的生长。
据悉,浙江大学生命科学学院易文教授为本文通讯作者,易文教授课题组的博士研究生聂颢为本文的第一作者。
原文链接:
https://www.nature.com/articles/s41467-019-13601-8
参考文献
1. Vander Heiden, M.G., L.C. Cantley,and C.B. Thompson, Understanding theWarburg effect: the metabolic requirements of cell proliferation. Science,2009. 324(5930): p. 1029-33.
2. Koppenol, W.H.,P.L. Bounds, and C.V. Dang, OttoWarburg's contributions to current concepts of cancer metabolism. Nat RevCancer, 2011. 11(5): p. 325-37.
3. Yang, X. and K.Qian, Protein O-GlcNAcylation: emergingmechanisms and functions. Nat Rev Mol Cell Biol, 2017. 18(7): p. 452-465.
4. Slawson, C. andG.W. Hart, O-GlcNAc signalling:implications for cancer cell biology. Nat Rev Cancer, 2011. 11(9): p. 678-84.
5. Hu, H., et al., Acetylation of PGK1 promotes liver cancer cell proliferation andtumorigenesis. Hepatology, 2017. 65(2):p. 515-528.
6. Li, X., et al., Mitochondria-Translocated PGK1 Functions asa Protein Kinase to Coordinate Glycolysis and the TCA Cycle in Tumorigenesis.Mol Cell, 2016. 61(5): p. 705-719.
7. Li, X., et al., Nuclear PGK1 Alleviates ADP-DependentInhibition of CDC7 to Promote DNA Replication. Mol Cell, 2018. 72(4): p. 650-660 e8.
8. Zhang, Y., et al.,Macrophage-Associated PGK1Phosphorylation Promotes Aerobic Glycolysis and Tumorigenesis. Mol Cell,2018. 71(2): p. 201-215 e7.
9. Qian, X., et al., PTEN Suppresses Glycolysis byDephosphorylating and Inhibiting Autophosphorylated PGK1. Mol Cell, 2019. 76(3): p. 516-527 e7.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479832&idx=5&sn=78b840b9251ff7111c8d8996a6229a3f&chksm=84e232ecb395bbfae28b775d5b9f889e10d207764d6dbf6a6abe28397e1ea01f7e7d2a5217c5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
治疗癌症的最好方法,是不要杀光所有癌细胞?



癌症演化树:揭示癌症转移机制


癌症转移,癌细胞最容易转移至哪些部位?
癌细胞“天线”如何影响癌症治疗效果
Nature癌症新发现:癌细胞能“传染”附近健康细胞

梦想青春不老?科学家用数学论证:衰老不可抵抗
癌细胞煮豆燃萁:或为癌症治疗提供新思路

靠不吃“饿死”癌细胞?癌症患者补品食用指南来了
癌症: 正在扩散当中的早期转移癌细胞的捕捉

靠不吃“饿死”癌细胞?癌症患者补品食用指南来了