科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-12
来源:BioArt
撰文 | 十一月
线粒体是细胞内关键的能量与代谢调控中心,而在癌症细胞中也担负着维持细胞生长和存活的重要作用。线粒体的核心功能是通过氧化磷酸化合成ATP。线粒体通过由电子传输链产生的膜电位梯度来驱动ATP的合成,从而维持氧化磷酸化作用【1】。在体外培养和异体移植的肿瘤细胞中均发现线粒体在肿瘤起始以及维持肿瘤细胞生长过程中发挥着非常重要的作用【2,3】。但目前为止,肿瘤细胞线粒体中氧化磷酸化作用的研究都局限于体外细胞培养的模型。因此,对于在生物体内发展测量线粒体电势等方面的技术需求呼之欲出。
近日,加州大学David B. Shackelford研究组在Nature发文,题为In vivo imaging of mitochondrial membrane potentialin non-small-cell lung cancer,提供了能够在体内测量非小细胞肺癌细胞线粒体电势的新技术,通过该技术可以对小鼠肺癌模型中异质性的癌症细胞进行分类,为活体癌症线粒体氧化磷酸化研究提供了重要的工具。

线粒体在肺癌基因工程小鼠中是肺癌发生发展所必须的组分【4】。为了对肺癌细胞中的线粒体电势进行分析,作者们采用了电压敏感的正电子放射断层扫描技术(Positron emission tomography, PET)。其中使用了放射性示踪剂4-[18F]fluorobenzyl-triphenylphosphonium,简称18F-BnTP【5】。18F-BnTP是带正电的亲脂阳离子,能够以一种电压依赖的方式定位在带负电的线粒体内膜之上【6,7】。虽然目前已经有一些利用质谱为基础的技术来测量线粒体膜电位,但是,Shackelford研究组的工作首次将18F-BnTP PET成像的技术引入小鼠活体肺癌模型中,并对线粒体膜电位进行测量。
在小鼠肺癌模型中使用18F-BnTP PET成像技术,首先需要考虑的是18F-BnTP注射到小鼠后的生物分布。在正常情况下,心脏、肝脏以及肠道会高剂量富集18F-BnTP。而在小鼠肺癌模型中,18F-BnTP不仅会富集到心脏位置,还会高度富集到肺癌发生的位置。但有趣的是,在非小细胞肺癌中存在明显不同强度的富集。通过肺癌细胞标记物进行染色后确认,在肺腺癌(Lung adenocarcinoma , ADC)中,18F-BnTP 密度更高,而在肺鳞状细胞癌(Lung squamous cell carcinoma , SCC)中,分布密度明显较低(图1)。那么作者们好奇两种非小细胞肺癌之间是否因为线粒体内容物存在差别而导致了18F-BnTP富集密度的差异呢?通过线粒体相关标记物染色后发现,ADC与SCC之间线粒体相关的蛋白含量并没有太大的差别。而通过不同的线粒体复合物抑制剂进行处理后发现,18F-BnTP是能够在体内、体外肺癌细胞中检测线粒体膜电位以及氧化磷酸化作用的电压敏感的探针。
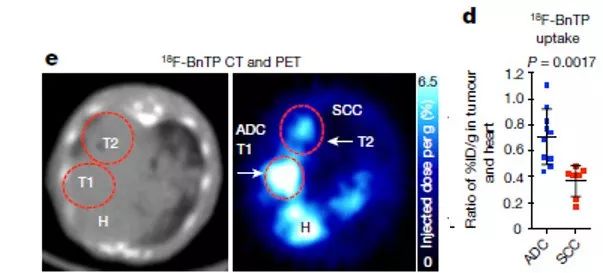
图1 18F-BnTP注射后在两种非小细胞肺癌中的分布强度存在差异
18F-BnTP能够精确地检测出在细胞水平施加氧酸磷酸化抑制剂导致的线粒体膜电位变化。18F-BnTP成像能够对线粒体复合物I活性的变化做出响应。这些结果都说明18F-BnTPPET成像可以对活体肺癌细胞中的线粒体电势变化进行测量。
更进一步地,作者们想要进行多种放射性示踪剂的PET成像。就如同活体荧光成像一样,除了绿色荧光蛋白还可以增加红色荧光蛋白、黄色荧光蛋白等进行多通道、多信号的成像。作者们使用18F-FDG( [18F]fluoro-2-deoxyglucose )与18F-BnTP联用的方式进行成像。18F-FDG常用于葡萄糖代谢过程。通过多示踪剂追踪的方式,作者们发现小鼠的肺癌细胞可以分为三类:1)18F-FDG富集程度高,18F-BnTP富集程度低的肺癌细胞;2)18F-FDG富集程度低,18F-BnTP富集程度高的肺癌细胞;3)两种示踪剂富集程度都变高的肺癌细胞。通过形态学以及细胞标记物染色后发现,18F-FDG富集程度高,18F-BnTP富集程度低的肺癌细胞是SCC细胞,而8F-FDG富集程度低,18F-BnTP富集程度高的肺癌细胞则是ADC细胞。这说明两种肺癌细胞不仅形态学上存在不同,生物能量代谢谱也存在明显差异。
总的来说,Shackelford研究组的工作将18F-FDG、18F-BnTP两种示踪剂联用的PET成像方式引入活体肺癌的研究之中,不仅能够检测出不同亚型肺癌细胞之中的代谢异质性,同时也提供了非入侵性的生物标记物,不仅是为肿瘤代谢领域也譬如衰老、病理学等方面提供了重要的线粒体活性测量成像工具。
原文链接:
https://doi.org/10.1038/s41586-019-1715-0
参考文献
1. Mitchell, P.& Moyle, J. Evidence discriminating between the chemical and thechemiosmotic mechanisms of electron transport phosphorylation. Nature 208, 1205-1206, doi:10.1038/2081205a0 (1965).
2. Morais,R. et al. Tumor-forming ability inathymic nude mice of human cell lines devoid of mitochondrial DNA. Cancer research 54, 3889-3896 (1994).
3. Cavalli,L. R., Varella-Garcia, M. & Liang, B. C. Diminished tumorigenic phenotypeafter depletion of mitochondrial DNA. Cellgrowth & differentiation : the molecular biology journal of the AmericanAssociation for Cancer Research 8,1189-1198 (1997).
4. Weinberg,F. et al. Mitochondrial metabolismand ROS generation are essential for Kras-mediated tumorigenicity. Proceedings of the National Academy ofSciences of the United States of America 107, 8788-8793, doi:10.1073/pnas.1003428107 (2010).
5. Madar,I. et al. Characterization of uptakeof the new PET imaging compound 18F-fluorobenzyl triphenyl phosphonium in dogmyocardium. Journal of nuclear medicine :official publication, Society of Nuclear Medicine 47, 1359-1366 (2006).
6. Madar,I. et al. Characterization ofmembrane potential-dependent uptake of the novel PET tracer 18F-fluorobenzyltriphenylphosphonium cation. Europeanjournal of nuclear medicine and molecular imaging 34, 2057-2065, doi:10.1007/s00259-007-0500-8 (2007).
7. Smith,R. A., Hartley, R. C. & Murphy, M. P. Mitochondria-targeted small moleculetherapeutics and probes. Antioxidants& redox signaling 15,3021-3038, doi:10.1089/ars.2011.3969 (2011).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479832&idx=4&sn=ec67ec3594b25e4f5e32d6996c15232c&chksm=84e232ecb395bbfa87d50dc8ccc04279be7de83b8bc47ac8626a10b6c56a59a1cef242ae6a74&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
多措并举、分类施策,有效降低肺癌死亡率

【分析】基于FRET机理构建比率荧光探针用于线粒体膜电位双色成像

运动可降低肺癌手术后并发症风险

“长寿药”首次用到人类身上效果惊人?并非如此!

肺癌大咖齐聚线上 共话肺癌精准诊疗|肺癌精准诊疗学术论坛精彩回顾
线粒体也能来自父亲

北方是家鸡的驯化中心?线粒体DNA分析不支持
线粒体DNA荧光成像新策略
仿生膜界面局域水结构随跨膜电位的演变
什么是肺癌?