科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-09-15
可溶性微针的研究进展
李锐婷 1,李丽云 2, 3,孙文强 2, 3,丁江生 2, 3*
(1. 云南中医药大学,云南 昆明 650500;2. 云南省药物研究所,云南 昆明 650111;3. 云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111)
[摘要]微针是一种新型经皮给药技术,具有无痛高效递送药物、良好的患者依从性以及便于自主给药等优势。较其他类型的微针而言,可溶性微针具有制备成本低、载药量大、应用范围广、无尖锐废弃物残留、易于控制药物释放等优点。综述可溶性微针的基质和制备方法、质量评价及其在药物递送、免疫接种等多个领域的应用,探讨可溶性微针发展中存在的问题并展望其未来的研究方向,为进一步开发、应用可溶性微针提供参考。
经皮给药系统是继口服、注射之后的第三大给药系统,具有改善患者依从性、持续给药、避免胃肠刺激和肝脏首过效应等优势 [1]。皮肤作为人体最大的器官,对机体保持水分、免受外来伤害起重要的屏障作用。皮肤的最外层为致密角质层,其厚度约为 15 ~ 20 μm,是经皮给药系统最主要的屏障,阻碍了药物的有效递送,限制了经皮给药的应用 [2]。迄今为止,美国食品和药物管理局(FDA)仅批准了 20 多种小分子药物(相对分子质量小于 400)用于经皮给药 [3]。1976 年,为克服传统经皮给药的局限性,Gerstel 和 Place [4] 首次提出微针递送药物的概念。直到 1998 年,Henry 等 [5] 才发表了首篇微针技术递送药物的研究。近年来,微针作为一种高效经皮药物输送的新技术得到了广泛研究。
微针是指直径小于几十微米、长度为 25 ~ 2 000μm 的针状结构 [6]。微针透皮给药是由数枚至数百枚细小微针组成的阵列,通过刺穿皮肤上角质层产生允许药物分子甚至药物颗粒直接传入皮下的微米级通道实现药物输送;微针经皮给药和常规(肌肉、皮下和皮内注射)给药不同(见图 1)[7],由于微针给药不易刺激神经末梢,不会或较少产生疼痛感;与传统的皮下、皮内、肌肉给药相比,微针给药可以提高患者依从性,减轻医护人员负担,提高给药的安全性和有效性。根据药物释放机制的不同,微针可以分为实心微针、中空微针、涂层微针、可溶性微针和水凝胶微针 5 种类型 [8]。
2005 年 Miyano 等 [9] 制备了首个可溶性微针。可溶性微针由水溶性材料制备而成,将药物分散于针体中,使用时微针根据“戳和释放”原理进行给药,即给药时微针插入皮肤,针体与皮肤间质液接触后溶解,药物在局部释放。与其他类型的微针相比,可溶性微针的制备工艺简单、制备材料丰富、交叉感染风险低、无尖锐废弃物残留,解决了硅、玻璃等微针针头断裂滞留于皮肤内难以处理的问题,且在一定程度上提高了微针的载药量,扩大了微针的应用范围。同时,根据治疗需求选择不同的制备材料及针体形状,可制备出快速释放、控释、缓释以及刺激响应释放药物等新型可溶性微针。本文对可溶性微针的研究进展进行综述,以期对可溶性微针的开发利用提供参考。
1 基质材料
可溶性微针大多由生物相容性好、毒性低、可塑性佳和低成本的可溶性或可降解聚合物及碳水化合物制备而成。一般,可溶性微针的基质材料应符合下列要求 [10]:1)生物相容性好、无毒,在临床已应用;2)材料性质稳定,不影响药物活性;3)具有足够的机械强度,能够刺入皮肤而不断裂;4)应用广泛,可塑性强;5)在皮肤中能溶解并控制药物的释放速率。
目前,制备可溶性微针最常用的基质材料是透明质酸钠(HA)和羧甲基纤维素钠(CMC-Na),这 2 种材料被 FDA 批准用于非肠道药物产品 [11]。此外,较常用的材料包括聚乙烯醇(PVA)[12]、聚乙烯基吡咯烷酮(PVP)[12]、硫酸软骨素(CS)[13]、羟丙甲纤维素(HPMC)[14]、碳水化合物材料(如麦芽糖和海藻糖)[15]等。
根据材料的力学特性,制备可溶性微针的基质材料可分为韧性材料和脆性材料 [16]。韧性材料具有较佳的柔韧性,可塑性较强,制备微针时不易破碎断裂,但微针的机械强度不足,无法刺入皮肤给药,如PVA、CMC-Na 等材料;脆性材料制备微针时机械强度佳,但给药时微针易过脆而断裂,如 PVP、CS 等。
HA 是一种具有良好生物相容性、高度黏弹性、可塑性、渗透性的安全可靠的生物材料和药物载体 [17]。相对分子质量不同的 HA,力学特性不同,制备微针时可根据实验需求选择不同相对分子量的HA。目前,HA 已广泛用于微针的制备,微针给药时,HA 可在组织液中迅速溶解,并在体内进行生物降解。
CMC-Na 是一种生物相容性好、成本低廉、水溶性稳定的高分子化合物。CMC-Na 快速溶于水后呈凝胶状态,制备的微针机械强度不足,固化时易变形。PVA 是一种亲水、生物相容良好、无毒、无致癌、无免疫原性的惰性高分子材料 [17],但使用PVA 时其存在不可逆的热凝胶化和长期保存时透明度损失的问题。制备微针时,PVA 能迅速吸收水分,变得柔软,从而增强微针的韧性,但影响微针的机械强度。因此,韧性材料适合与脆性材料混合使用以获得机械性能较好的微针。
麦芽糖是一种生物相容性佳、稳定性高、成本低、安全性好的碳水化合物。所有糖类中,麦芽糖制备微针的研究最多。麦芽糖微针机械强度佳,给药时能在皮肤中快速释放有效成分,当皮肤吸收麦芽糖时,其在体内是可生物降解的,肾脏会逐渐将其清除 [17]。但是,糖类作为基质制备的微针用途有限。诊断研究领域,糖类可能会干扰诊断结果,特别是血糖的测定。
2 制备方法
微针最早的制备方法是微机电系统(MEMS)技术,在此基础上发展出了激光切割、光刻、湿法和干法刻蚀、微模塑法等方法。目前,可溶性微针的制备方法包括溶剂浇铸、光刻、液滴空气吹法、3D 打印、拉伸平版印刷法、热压、微模塑法和超声波焊接等,其中,最常用、最简单、最方便的方法是微模塑法。
3D 打印是一种制备可溶性微针的新技术,通过计算机辅助设计(CAD),可以快速设计和打印出微针,且可自定义针密度、长度和形状。常用的 3D打印技术包括选择性激光烧结(SLS)、立体光刻(SLA)和熔融沉积模型(FDM)。SLS 和 SLA 打印机能够生产小于 100 μm 的微针,但这些打印机价格昂贵,而且制备材料大都不具有生物相容性;FDM 用途广泛,成本效益高,可利用生物相容性较好的材料进行打印,如聚乳酸(PLA)和 PVA 等,但 FDM 技术的分辨率低于其他印刷方法,制备的样品不够精细 [18]。Luzuriaga 等 [18] 展示了一种新的制备方法,将 FDM 技术与湿法蚀刻相结合制备微针(见图 2),该方法能显著改善微针的打印尺寸,得到理想的尺寸和形状。
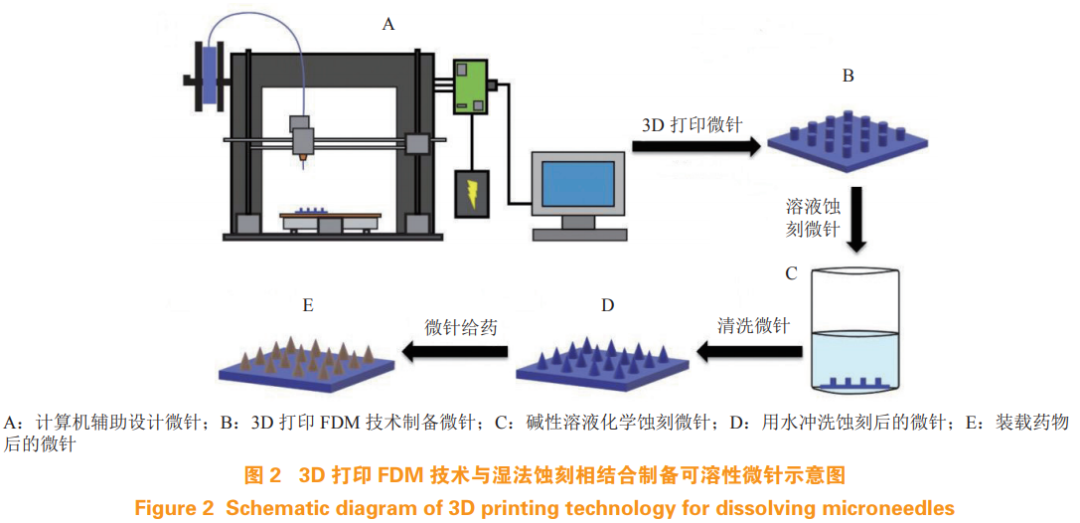
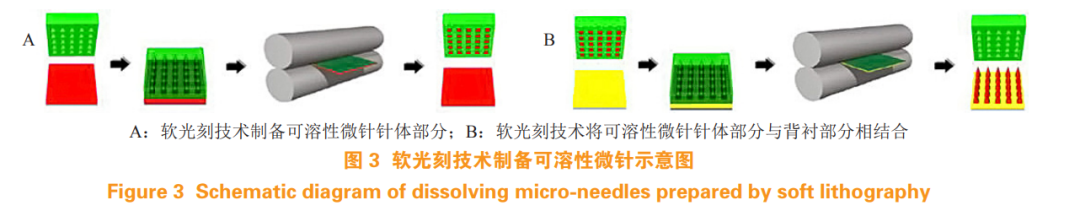
光刻技术是一种简单的微针制备工艺,可以精确控制微针的尺寸、形状和制备材料。软光刻技术制备可溶性微针的步骤:先将聚合物膜与微针模具配对,通过加热辊进行填充,然后将填充好的模具放在可溶于水的柔性衬底上,再次通过加热辊分离模具,微针保留在背衬材料上制成微针贴片(见图3)[19]。此外,加热辊固化也可以使用光固化来代替。软光刻法制备可溶性微针与立体平板拉伸法类似,具有高效和低成本的优势及良好的可扩展性。然而,该方法制备时需要在高温状态下进行,不适用于热敏性药物的制备。Moga 等 [19] 通过软光刻技术,使用 PVP 溶液制成的聚合物膜与全氟聚醚(PFPE)微针模具在 105℃条件下成功制备了可溶性微针。
3 质量评价
目前,可溶性微针在国内外药典中均无相关标准对其进行评价,且在药物递送领域尚未有上市产品,上市产品均为化妆品,其相关质量标准尚不完善。据研究报道 [11, 20-24],可溶性微针主要从以下几个方面进行质量评价。
3.1 物理特性
通常,可以通过目测、体式显微镜和扫描电子显微镜(SEM)等手段来评估微针的几何结构,表征微针的尺寸、表面形态以及微针在阵列上的分布等 [20]。同时,显微镜技术也可以应用于通过荧光素标记药物来分析药物在微针中的分布情况。
3.2 机械强度
可溶性微针应具备良好的机械强度和韧性,可以插入皮肤并将药物输送到皮下组织,且能抵抗断裂和弯曲破坏。微针的机械强度与制备微针的基质材料、微针的含水量、微针的几何形状等相关。通常,将机械强度实验与插入研究相结合,根据插入力、插入深度、微针穿透成功率等参数进行评价 [11]。
3.3 体外渗透性
可溶性微针中体外渗透性研究对其给药时间、给药剂量至关重要。采用 Franz 立式扩散池开展微针的体外经皮渗透性研究,将微针贴片作用于中间的皮肤角质层(通常是动物皮肤或人工合成膜)上,以缓冲液为接受液,在不同的时间点进行取样,采用高效液相色谱法、紫外分光光度法等方法定量分析微针贴片中药物的溶出量、溶出速率以及溶出曲线,并观察微针的溶解状态,测量微针长度的变化[21]。
3.4 体内药代动力学
微针的体外渗透研究存在一定的局限性,体内药代动力学研究可以对微针贴片的药效学和安全性进行评价。常选小鼠和大鼠进行微针的药代动力学评价,因为在啮齿类动物中,老鼠的皮肤与人类最为相似,且造模较为方便 [22]。微针贴片给药前后,分别在相应的时间点抽取适量老鼠的血液进行检测,对药代动力学参数如血药峰浓度(Cmax)、达峰时间(Tmax)等进行研究。
3.5 对皮肤刺激性和恢复情况
微针贴片给药后,皮肤最常见的不良反应包括作用部位出现轻微、短暂的红斑和水肿。Kusamori等 [23] 试图通过 Draize 方法量化使用微针前后皮肤产生红斑、水肿的程度来评价微针对皮肤的刺激性,但 Draize 方法相对主观,不同的实验者可能会存在一定差异。同时,微针对皮肤的恢复情况可用经皮水分丢失(TEWL)来评价,对比使用微针前后的TEWL 值差异,通过角质层水分散失的情况来评价皮肤的受损情况,但需要考虑由于皮肤的弹性,微针给药通道恢复,TEWL 值会随着时间的推移而缓慢降低。
3.6 稳定性
可溶性微针的稳定性研究主要考察不同温度、湿度对微针贴片的影响。将微针贴片放置于不同温度、湿度的环境中,考察微针贴片的物理和化学稳定性,如微针机械强度、药物稳定性等。Mistilis 等 [24] 开展流感疫苗可溶性微针贴片的稳定性研究,将微针贴片分别置于 4 种不同的条件下,即 25℃下储存 24 个月、60℃下储存 4 个月、进行 5 次冻融循环储存和电子束辐照储存,结果表明疫苗活性均无显著变化。
4 应用
可溶性微针具有给药效率高、安全性好、生物相容性好等优势,在药物递送、免疫接种、美容美体、疾病诊断等领域已有广泛研究和应用。
4.1 药物的递送
目前,可溶性微针已被广泛用于多种药物的经皮给药,如小分子药物利多卡因、咖啡因、蒿甲醚、阿仑膦酸盐等,以及大分子药物、蛋白质、激素、多肽等。表 1 总结了部分可溶性微针递送药物分子用于疾病治疗的研究情况。
4.2 疫苗的递送
2010 年,可溶性微针首次用于疫苗的递送 [32]。大多数疫苗接种是通过肌内或皮下注射完成,但接种方式会产生疼痛感。可溶性微针将免疫载体导入皮肤,增强免疫反应。研究表明,与传统的给药方式相比,微针接种具有抗原稳定性高、用量小和强免疫原性等优势,且微针接种通常不需要冷链保存,成本较低[33]。目前,可溶性微针已用于递送多种疫苗的研究。
Yan 等 [34] 使用可溶性微针对结核分枝杆菌分泌蛋白 Ag85B DNA 疫苗进行递送以预防结核病。在小鼠体内进行给药,当免疫剂量较低(4.2 μg)时,微针给药接种和肌内注射接种的免疫反应无显著差异;当剂量较高(12.6 μg)时,微针接种产生的免疫反应比肌内注射接种的反应强。该研究表明,可溶性微针接种 Ag85B DNA 疫苗能提高疫苗的免疫活性,为结核病提供一种新的防治方法。
Kim 等 [35] 利用其在冠状病毒疫苗和微针给药方面的丰富经验,快速研发出负载重组冠状病毒(SARS-CoV-2)疫苗的可溶性微针。研究表明,小鼠接种 SARS-CoV-2 微针疫苗后 2 周内能引起明显的病毒特异性抗体反应。重要的是,SARSCoV-2 微针疫苗经 γ 射线彻底消毒后仍能保持其效力,这是制备适合人类使用产品的关键步骤。该研究为临床研制可溶性微针接种抗新型冠状病毒肺炎(COVID-19)等新型传染病疫苗提供了可行依据。

4.3 美容美体
近几十年来,微针在美容美体领域也取得了重大进展,在市场上已使用十多年,主要用于疤痕的治疗、美白、除皱、黄褐斑及疤痕的治疗等。目前,日本 Cosmed 制药公司使用透明质酸钠和胶原蛋白研发并上市了用于美白、祛斑的微针产品 MicroHyala®,这是世界上首个成功上市的可溶性微针产品。
Xie 等 [36] 开发了一种治疗皮肤增生性瘢痕的博来霉素载药可溶性微针(BMN)。BMN 具有足够的机械强度插入皮肤,体外研究表明,1 min 内微针溶解释放 20% 的博来霉素,10 min 内微针完全溶解并释放 52% 的药物。同时,博来霉素可溶性微针可以抑制人增生性瘢痕成纤维细胞(HHSFB)的增殖和转化生长因子 b1(TGF-b1)的分泌,为治疗增生性瘢痕提供一条方便、高效、微创的途径。
Aung 等 [14] 使用 HPMC/PVP 基质开发了负载 α熊果苷的可溶性微针用于皮肤美白,可溶性微针 45min 内完全溶解,经皮累积渗透量为 312.23 μg。与传统制剂相比,可溶性微针中 α-熊果苷的经皮渗透量为凝胶制剂的4倍。此外,使用可溶性微针贴片后,皮肤可以自然愈合,无感染现象,在加速条件储存4 周药物活性保持稳定。
4.4 疾病诊断
微针贴片作为一种简化的诊断工具越来越受到人们青睐,可以递送过敏原用于过敏诊断,也可对微量血液或间质液进行采样,检测生物标志物等。与传统技术相比,可溶性微针可以提供一种微创、无痛、无不良反应的诊断方法。
结核菌素皮肤试验(TST)是一种结核病筛查方法。Wang 等 [37] 使用可溶性微针将纯化蛋白衍生物结核菌素递送至皮肤以检测结核病。经人体试验研究结果表明,微针 1 h 完全溶解,TST 产生皮肤反应时,微针贴片所需结核菌素的剂量(0.04 IU)仅为常规注射剂量(2 IU)的 1/50。与常规注射相比,微针递送结核菌素在肺结核患者皮肤表面产生的红肿更小、持续时间更短,在健康人体中的皮肤反应不明显。由此可知,采用可溶性微针能安全、有效地诊断结核病,为其临床应用提供了一定的参考依据。
万古霉素(vancomycin,VCM)是一种糖肽类抗生素,主要用于革兰阳性菌引起的肺炎、肺脓肿等疾病,但 VCM 给药后有许多不良反应,提倡对其进行治疗药物监测。Ito 等 [38] 设计一种无痛的VCM 监测方法,通过不同时间可溶性微针插入皮肤形成的孔道抽取皮肤间质液(ISF)进行检测,发现ISF-VCM 浓度与 VCM 的血药浓度相关性显著,且使用可溶性微针对皮肤不产生损伤、不引起炎症。因此,与血液采样相比,通过可溶性微针采集间质液监测 VCM 是一种更安全、更有效的方法。
5 结语与展望
近几十年来,可溶性微针作为一种新型的经皮给药方式,因其优势众多,逐渐被开发应用于多种药物分子尤其是大分子药物的递送,但大多数仍处于研发阶段。可溶性微针作为最具应用前景的一类微针,制备材料丰富多样,制备方法日益改进,微针性能逐渐完善,在药物递送、疫苗接种、疾病诊断及化妆品等领域也取得了重大进展,但仍面临许多问题亟待解决。如大多数聚合物材料和碳水化合物制备可溶性微针时机械强度不足,刺入皮肤时可能发生弯曲、断裂等情况,影响微针的疗效。同时,制备可溶性微针的聚合物在体内溶解后可能部分沉积于皮肤中,可能形成肉芽、局部产生红斑或积聚在体内器官中,长期产生的影响目前尚不完全清楚。此外,可溶性微针的工业化生产需要无菌条件,批量生产面临许多困难需要进一步解决。
未来,研究人员制备可溶性微针时可选择机械强度良好、可在体内降解的新材料,探寻可溶性微针新的制备方法和生产工艺,赋予微针新的性能,如微针实现智能调控给药等。相信随着科学技术的发展和研究人员的不断努力,能一步一步解决现存的问题,走向临床应用,开发出更多安全、高效、经济、应用广泛的可溶性微针产品。
参考文献
Peña-Juárez M C, Guadarrama-Escobar O R, Escobar-Chávez J J.Transdermal delivery systems for biomolecules[J]. J Pharm Innov,2021: 1-14. DOI: 10.1007/s12247-020-09525-2.
Yang D, Chen M, Sun Y, et al. Microneedle-mediated transdermaldrug delivery for treating diverse skin diseases[J]. Acta Biomater,2020, 121: 119-133.
Amjadi M, Sheykhansari S, Nelson B J, et al. Recent advances inwearable transdermal delivery systems[J]. Adv Mater, 2018, 30(7):1704530. DOI: 10.1002/adma.201704530.
Gerstel M S, Place V A. Drug delivery device: US3964482A[P].1976-06-22.
Henry S, McAllister D V, Allen M G, et al. Microfabricatedmicroneedles: a novel approach to transdermal drug delivery[J]. JPharm Sci, 1998, 87(8): 922-925.
Donnelly R F, Singh T, Morrow D, et al. Microneedle-mediatedtransdermal and intradermal drug delivery[M]. 2012 Edition.America: Wiley-Blackwell, 2012: 15-16.
van der Maaden K, Jiskoot W, Bouwstra J. Microneedle technologiesfor (trans)dermal drug and vaccine delivery[J]. J Control Release,2012, 161(2): 645-655.
Alimardani V, Abolmaali S S, Yousefi G, et al. Microneedle arrayscombined with nanomedicine approaches for transdermal deliveryof therapeutics[J]. J Clin Med, 2021, 10(2): 181. DOI: 10.3390/jcm10020181.
Miyano T, Tobinaga Y, Kanno T, et al. Sugar micro needles astransdermic drug delivery system[J]. Biomed Microdevices, 2005,7(3): 185-188.
Bhatnagar S, Dave K, Venuganti V V K. Microneedles in the clinic[J].J Control Release, 2017, 260: 164-182.
Leone M, Mönkäre J, Bouwstra J A, et al. Dissolving microneedlepatches for dermal vaccination[J]. Pharm Res, 2017, 34(11): 2223-2240.
Kim J S, Choi J A, Kim J C, et al. Microneedles with dualrelease pattern for improved immunological efficacy of hepatitisB vaccine[J]. Int J Pharm, 2020, 591: 119928. DOI: 10.1016/j.ijpharm.2020.119928.[
Liu S, Zhang S, Duan Y, et al. Transcutaneous immunization ofrecombinant staphylococcal enterotoxin B protein using a dissolvingmicroneedle provides potent protection against lethal enterotoxinchallenge[J]. Vaccine, 2019, 37(29): 3810-3819.
Aung N N, Ngawhirunpat T, Rojanarata T, et al. HPMC/PVPdissolving microneedles: a promising delivery platform to promotetrans-epidermal delivery of alpha-arbutin for skin lightening[J]. AAPSPharmSciTech, 2019, 21(1): 25. DOI: 10.1208/s12249-019-1599-1.
Zhang L, Li Y, Wei F, et al. Transdermal delivery of salmon calcitoninusing a dissolving microneedle array: characterization, stability, andin vivo pharmacodynamics[J]. AAPS PharmSciTech, 2020, 22(1): 1.DOI: 10.1208/s12249-020-01865-z.
章捷 , 马凤森 , 占浩慧 , 等 . 用于构建可溶性微针的基质材料及其复合材料 [J]. 材料导报 , 2017, 31(19): 129-134, 161.
Bhatnagar S, Gadeela P R, Thathireddy P, et al. Microneedle-baseddrug delivery: materials of construction[J]. J Chem Sci, 2019, 131(9):90-117
Luzuriaga M A, Berry D R, Reagan J C, et al. Biodegradable 3Dprinted polymer microneedles for transdermal drug delivery[J]. LabChip, 2018, 18(8): 1223-1230.[
Moga K A, Bickford L R, Geil R D, et al. Rapidly-dissolvablemicroneedle patches via a highly scalable and reproducible softlithography approach[J]. Adv Mater, 2013, 25(36): 5060-5066.
Sabri A H , Kim Y, Marlow M, et al. Intradermal and transdermaldrug delivery using microneedles-fabrication, performance evaluationand application to lymphatic delivery[J]. Adv Drug Deliv Rev, 2019,153: 195-215.
Larrañeta E, Stewart S, Fallows S J, et al. A facile system to evaluatein vitro drug release from dissolving microneedle arrays[J]. Int JPharm, 2016, 497(1/2): 62-69.
Thakur R R S, Tekko I A, Al-Shammari F, et al. Rapidly dissolvingpolymeric microneedles for minimally invasive intraocular drugdelivery[J]. Drug Deliv Transl Res, 2016, 6(6): 800-815.
Kusamori K, Katsumi H, Abe M, et al. Development of anovel transdermal patch of alendronate, a nitrogen-containingbisphosphonate, for the treatment of osteoporosis[J]. J Bone MinerRes, 2010, 25(12): 2582-2591.
Mistilis M J, Joyce J C, Esser E S, et al. Long-term stability ofinfluenza vaccine in a dissolving microneedle patch[J]. Drug DelivTransl Res, 2017, 7(2): 195-205.
Zhan H, Ma F, Huang Y, et al. Application of composite dissolvingmicroneedles with high drug loading ratio for rapid localanesthesia[J]. Eur J Pharm Sci, 2018, 121: 330-337.
Liu D, Yu B, Jiang G, et al. Fabrication of composite microneedlesintegrated with insulin-loaded CaCO3 microparticles and PVP fortransdermal delivery in diabetic rats[J]. Mater Sci Eng C Mater BiolAppl, 2018, 90: 180-188.
Qiu Y, Li C, Zhang S, et al. Systemic delivery of artemether bydissolving microneedles[J]. Int J Pharm, 2016, 508(1/2): 1-9.[
Maurya A, Rangappa S, Bae J, et al. Evaluation of soluble fentanylmicroneedles for loco-regional anti-nociceptive activity[J]. Int J.Pharm, 2019, 564: 485-491.
Katsumi H, Tanaka Y, Hitomi K, et al. Efficient transdermal deliveryof alendronate, a nitrogen-containing bisphosphonate, using tiploaded self-dissolving microneedle arrays for the treatment ofosteoporosis[J]. Pharmaceutics, 2017, 9(3): 29. DOI: 10.3390/pharmaceutics9030029.
Li W, Terry R N, Tang J, et al. Rapidly separable microneedle patchfor the sustained release of a contraceptive[J]. Nat Biomed Eng, 2019,3(3): 220-229.
Yan Q, Wang W, Weng J, et al. Dissolving microneedles fortransdermal delivery of huperzine A for the treatment of Alzheimer'sdisease[J]. Drug Deliv, 2020, 27(1): 1147-1155.
Raphael A P, Prow T W, Crichton M L, et al. Targeted, needle-freevaccinations in skin using multilayered, densely-packed dissolvingmicroprojection arrays[J]. Small, 2010, 6(16): 1785-1793.
Richter-Johnson J, Kumar P, Choonara Y E, et al. Therapeuticapplications and pharmacoeconomics of microneedle technology[J].Expert Rev Pharmacoecon Outcomes Res, 2018, 18(4): 359-369.
Yan Q, Cheng Z, Liu H, et al. Enhancement of Ag85B DNA vaccineimmunogenicity against tuberculosis by dissolving microneedles inmice[J]. Vaccine, 2018, 36(30): 4471-4476.
Kim E, Erdos G, Huang S, et al. Microneedle array deliveredrecombinant coronavirus vaccines: immunogenicity and rapidtranslational development[J]. EBioMedicine, 2020, 55: 102743. DOI:10.1016/j.ebiom.2020.102743.
Xie Y, Wang H, Mao J, et al. Enhanced in vitro efficacy for inhibitinghypertrophic scar by bleomycin-loaded dissolving hyaluronic acidmicroneedles[J]. J Mater Chem B, 2019, 7(42): 6604-6611
Wang W, Liu H M, Zhou J, et al. Skin test of tuberculin purifiedprotein derivatives with a dissolving microneedle-array patch[J].Drug Deliv Transl Res, 2019, 9(4): 795-801.
Ito Y, Inagaki Y, Kobuchi S, et al. Therapeutic drug monitoringof vancomycin in dermal interstitial fluid using dissolvingmicroneedles[J]. Int J Med Sci, 2016, 13(4): 271-276.
关于药学进展
感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2021年第6期。
《药学进展》杂志是由中国药科大学和中国药学会共同主办、国家教育部主管,月刊,80页,全彩印刷。刊物以反映药学科研领域的新方法、新成果、新进展、新趋势为宗旨,以综述、评述、行业发展报告为特色,以药学学科进展、技术进展、新药研发各环节技术信息为重点,是一本专注于医药科技前沿与产业动态的专业媒体。
《药学进展》注重内容策划、加强组稿约稿、深度挖掘、分析药学信息资源、在药学学科进展、科研思路方法、靶点机制探讨、新药研发报告、临床用药分析、国际医药前沿等方面初具特色;特别是医药信息内容以科学前沿与国家战略需求相合,更加突出前瞻性、权威性、时效性、新颖性、系统性、实战性。根据最新统计数据,刊物篇均下载率连续三年蝉联我国医药期刊榜首,复合影响因子0.760,具有较高的影响力
《药学进展》编委会由国家重大专项化学药总师陈凯先院士担任主编,编委新药研发技术链政府监管部门、高校科研院所、制药企业、临床医院、CRO、由金融资本及知识产权相关机构百余位极具影响力的专家组成。
来源:ppsyxjz 药学进展
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651320351&idx=1&sn=03bea39dbcdb1ead10293467c4845317
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

机智如鸦:新喀里多尼亚乌鸦会使用复杂的钩型工具

科普一分钟 | 新型的微针贴片

布满微针的贴片或让坐着减肥成现实

业界 | 写作比写代码难多了?给数据科学家的写作指南
微针介导的基因传递治疗缺血性心肌病

东非出土32万年前的人造工具,人类进化起点被大大提前
科学家开发无需抽血即可检测疟疾的微针装置
“脱发”有救了?微针贴片助生发!

赵远锦教授Science Bulletin:仿螳螂爪子的卡扣微针贴片

Science子刊::量子点微针贴片记录疫苗接种大数据