科技工作者之家
加好友
科技工作者之家 2021-09-24
2021年9月23号,中国科学院上海药物研究所蒋轶/徐华强团队、赵强团队、吴蓓丽团队、王明伟/杨德华团队和上海科技大学赵素文团队背靠背于Nature Chemical Biology 在线发表了题目分别为 ”Ligand recognition and G protein-coupling promiscuity of cholecystokinin A receptor” 和“Structures of the human cholecystokinin receptors bound to agonists and antagonists”的两项研究成果,解析了2种小分子拮抗剂(Devazepide、Lintitript)和激动剂NN9056与A型人源缩胆囊素受体(Cholecystokinin receptor,CCKAR)结合的3个晶体结构,以及多肽激素CCK-8的CCKAR分别与3种不同G蛋白(Gs、Gi、Gq)偶联复合物和多肽Gastrin-17分别与B型缩胆囊素受体(CCKBR)和两种G蛋白(Gi、Gq)形成复合物的5个冷冻电镜结构。他们系统性地揭示了多种多肽和小分子配体特异性识别缩胆囊素受体亚型的结构基础,阐明了配体选择性和受体活化的分子机制,破解了CCKAR选择性偶联不同G蛋白的生命奥秘,从而为靶向该类受体的药物研发提供了重要信息。


缩胆囊素(Cholecystokinin, CCK)是早在1968年就被提取鉴定的胃肠激素之一。CCK和胃泌素(Gastrin)是酪氨酰磺酸化多肽家族成员,具有保守的羧基末端八肽序列。两者在胃肠道和中枢神经系统中含量丰富,通过与缩胆囊素受体结合发挥激素调节和神经递质的作用。缩胆囊素受体包括A和B两个亚型(CCKAR和CCKBR),属于A类G蛋白偶联受体(GPCR)。CCKAR特异性识别磺酸化的CCK,而CCKBR对磺酸化和非磺酸化的CCK和Gastrin均具有较强的亲和力。这两类CCK受体参与调控的生理功能包括饱腹感、胰酶分泌和胆囊收缩、同时也与焦虑、记忆和药物成瘾等相关,因而是肥胖症、2型糖尿病和焦虑症等疾病的潜在治疗靶标。
高选择性CCKAR非肽类拮抗剂(如Devazepide和Lintitript)被开发用来治疗胃肠功能紊乱、神经性疼痛和胰腺癌等疾病,而其激动剂NN9056对肥胖症具有一定疗效。但由于低药效和生物利用度等问题,大多数靶向CCKR的候选药物终止于临床研究。因此,开展CCKR的结构与功能研究将深化对其配体识别机制的认识,助力相关新药的创制。
GPCR被配体激活后主要通过偶联细胞内的G蛋白进行信号转导。根据α亚基的不同,G蛋白可分为Gi/o、Gs、Gq/11和G12/13d等四亚家族。虽然目前已经报道了不同GPCR与其下游G蛋白的结合的大量复合物结构,但受体如何精确识别这四种G蛋白一直困扰着科研人员。由于CCKAR能够偶联这四种不同的G蛋白,因而成为研究GPCR与G蛋白选择性结合机制的模式受体。
在第一项研究中,蒋轶/徐华强/王明伟/杨德华联合团队解析了磺酸化CCK-8激活的CCKAR与Gq、Gs和Gi蛋白偶联的复合物冷冻电镜结构,分辨率分别为2.9 Å、3.1 Å和3.2 Å(图1a)。结合结构分析和功能验证,该工作展示了内源多肽激素—磺酸化CCK-8(以下简称CCK-8)的结合模式:CCK-8的氨基末端由受体的三个胞外环(ECL)紧紧包裹,其羧基末端插入受体的正构口袋。他们还鉴定了识别CCK-8的关键氨基酸残基和磺酸化基团发挥CCK-8活性的关键位点:位于CCKAR上ECL2区域的R197与CCK-8第二位酪氨酸修饰的磺酸基通过盐键结合进而决定磺酸化多肽的高亲和力(图1b)。
此外,该研究也对CCKAR选择性偶联Gq、Gs和Gi的分子机理进行了阐述,并提出了ICL3参与CCKAR与Gq偶联的新机制。科研人员发现,偶联三种不同G蛋白的受体呈现相似的激活构象,然而受体与不同G蛋白结合界面的面积显示Gq > Gs > Gi的趋势。与之一致,CCKAR与其主要下游信号蛋白Gq偶联时产生的最大的激活效应(Emax)显著高于Gs和Gi。这些结果支持Gq是CCKAR主要偶联的G蛋白类型,明确了接触面积在G蛋白选择性识别中的作用。这项工作进一步证实了Gq、Gs和Gi蛋白α亚基α5螺旋的末端弯钩(Wavy hook)是CCKAR对G蛋白选择性的参与者(图1c)。在CCKAR与Gq的复合物中,他们还发现CCKAR胞内环ICL3的I296与Gαq亚基的一个疏水结合口袋结合,这也是首次在GPCR结构中观测到ICL3与Gα亚基的相互作用方式(图1d)。相反,由于Gαs和Gαi与Gαq在该疏水口袋残基组成的差异,CCKAR的相应ICL3区域与Gs和Gi不存在该疏水作用,说明ICL3决定了G蛋白之选择性。
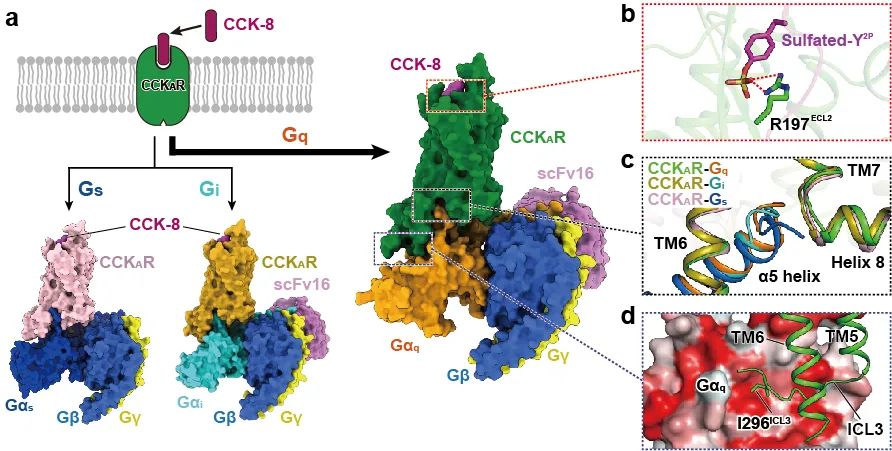
图1. 内源多肽CCK-8活化的CCKAR与和不同G蛋白偶联的冷冻电镜结构。
在第二项研究中,赵强/吴蓓丽/王明伟/杨德华/赵素文联合团队解析了CCKAR与小分子拮抗剂Devazepide、Lintitript和激动剂NN9056结合的三个晶体结构,以及结合多肽Gastrin的CCKBR分别与Gi和Gqo偶联的两个复合物冷冻电镜结构(图2a-e)。该工作揭示了多肽和小分子拮抗剂识别CCKR的分子机制,发现了ECL2是CCKAR和CCKBR选择性识别多肽配体的决定因素。ECL2上的H207与多肽中D2形成的氢键决定了CCKBR对CCK-8、CCK-8ns和Gastrin-17的高亲和力(图2f),而ECL2上的R197与多肽中Y7的磺酸基形成的盐键决定了CCK-8对CCKAR的高选择性(图2g)。同时,科研人员还发现N3336.55和R3366.58在CCKAR识别Devazepide和Lintitript过程中发挥了关键作用,为后继选择性靶向药物的开发奠定了基础。
此外,科研人员通过比对CCKAR结合拮抗剂Devazepide的结构、CCKAR结合激动剂NN9056的结构以及CCKAR同时结合激动剂CCK-8ns和Gq蛋白的结构,结合分子动力学模拟实验,阐释了CCKAR逐步激活的过程。相对于拮抗剂,激动剂在结合口袋中结合更深(图2h),随后引起PIF和FxxCWxP保守基序的变化(图2i和2j),进而导致受体胞内部分发生TM6和TM5向外以及TM7向内移动的激活态构象变化,从而揭示了CCKAR逐步激活的分子机制。
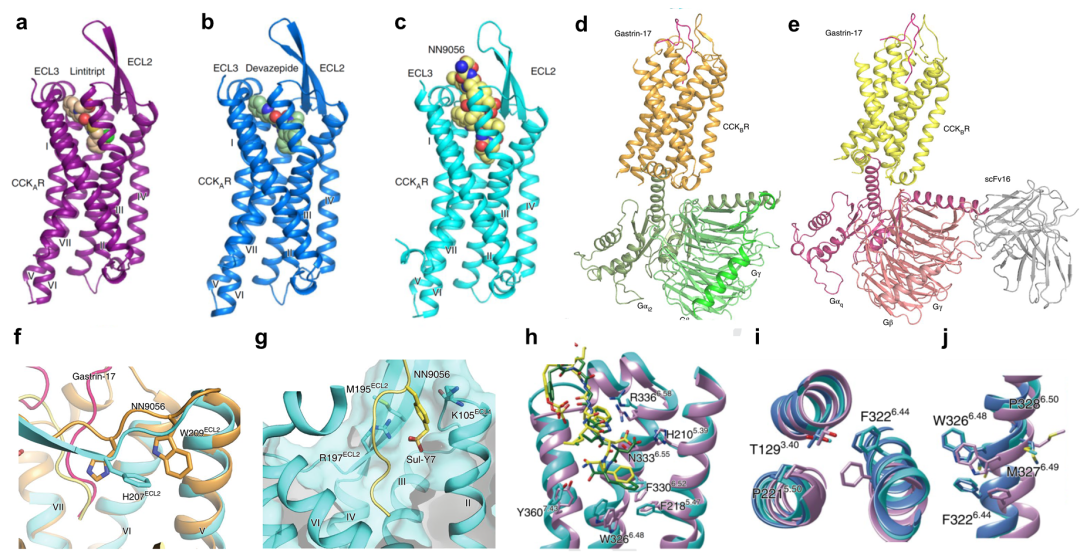
图2. CCKR分别与小分子拮抗剂和多肽激动剂结合的三维结构。
第一项研究由上海药物所蒋轶/徐华强研究团队领衔,联合王明伟/杨德华团队,并在英国剑桥大学Tristan I. Croll的帮助下完成。上海药物所博士后刘秋枫、研究员杨德华和特别研究助理庄友文为共同第一作者。第二项研究由上海药物所赵强/吴蓓丽领衔,联合王明伟/杨德华团队和上海科技大学赵素文团队,并在丹麦诺和诺德公司Ulrich Sensfuss和Steffen Reedtz-Runge等的帮助下完成。上海药物所博士研究生张雪锋、复旦大学药学院博士研究生何承霖、上海药物所博士研究生王沐、复旦大学基础医学院青年研究员周庆同、上海药物所研究员杨德华和博士后朱亚为本文共同第一作者。上海药物所为两篇论文的第一完成单位,冷冻电镜数据在上海药物所冷冻电镜中心收集。该工作获得了国家科技部重点研发计划、国家卫健委科技重大专项、国家自然科学基金委、中国科学院先导项目和上海市科技重大专项等经费的资助。
来源: iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247536209&idx=7&sn=c529817cf6c345c652c3b951a30beb78
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

铱催化羟胺的化学选择性、区域选择性以及对映选择性烯丙基化反应研究

南开Science,崔屹/冯新亮Science等|顶刊日报20191122
张杰鹏团队Angew:选择性氧化 MOF 提高丙烯/丙烷分离选择性

拓展G蛋白和G蛋白偶联受体相互作用“图谱”
选择性蛋白尿指数

重要! G蛋白偶联受体家族成员的结构解析

我院崔隽教授课题组揭示细胞自噬调控非经典NF-kB通路和炎症反应的新机制

《Science》发文:脂肪胺N-H键的高对映选择性卡宾插入合成手性氨基酸

JACS:烷基锆选择性迁移与锆硼试剂的选择性偶联

Sci Adv : 安进亚洲研发中心首次研究出G蛋白偶联受体抗体激动剂