科技工作者之家
加好友
科技工作者之家 2021-09-29

天津大学化工学院李凤副教授和研究生吕兆月为共同第一作者。
细胞内的氧化还原平衡是维持正常细胞代谢和功能的重要基础。在肿瘤细胞内,由于基因突变造成代谢异常,活性氧水平高于正常细胞,通过外界刺激下更易于达到活性氧阈值,造成细胞损伤。
Nrf2是调控氧化还原平衡的关键转录因子,可调控细胞内多种抗氧化酶的表达。利用基因药物调控肿瘤细胞内Nrf2的表达,能够增强肿瘤细胞氧化应激并抑制其生长,是一种极具潜力的肿瘤治疗策略。
如何开发安全高效的基因递送体系并实现与其他治疗方法的协同增强是该策略实现突破的关键。
DNA是一种功能性生物大分子,具有分子识别性、序列可编程性及可调的生物活性,且可与其他体系耦合实现多级次组装,精准构筑智能型DNA功能材料,在核酸药物递送领域展现出良好的应用前景。
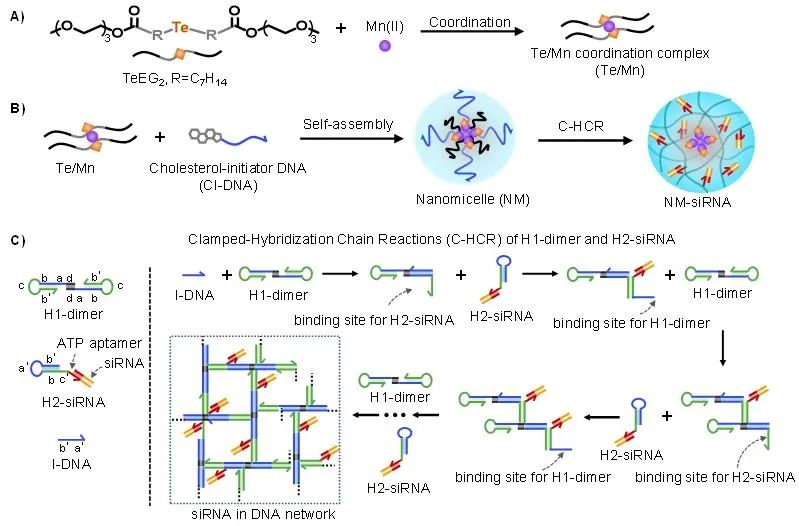
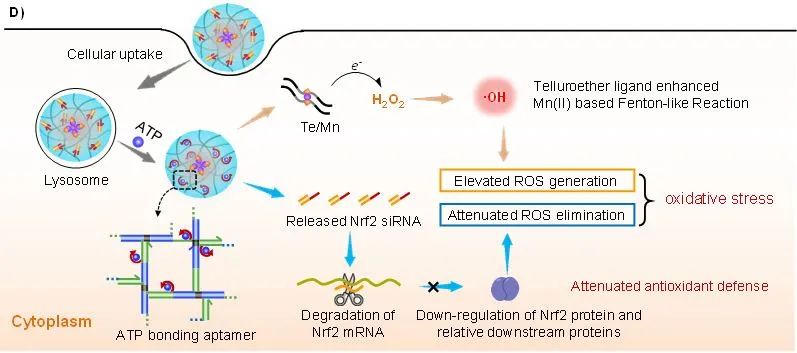
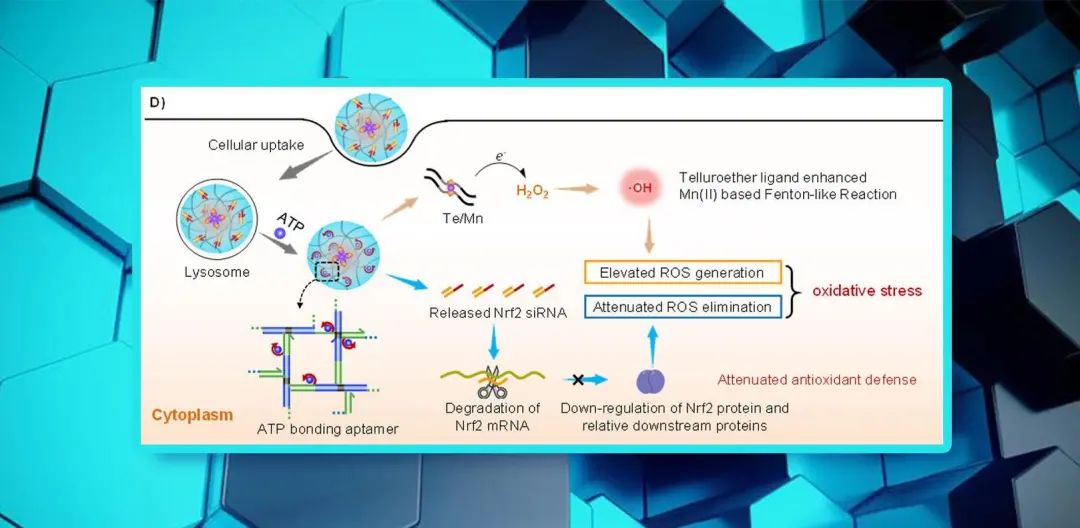
图1. 超分子自组装 DNA 纳米系统实现肿瘤细胞化学和基因的协同调控:A)和B)超分子自组装DNA纳米系统构建策略示意图;C)DNA级联组装实现siRNA高效装载;D)细胞内siRNA特异性可控释放,实现肿瘤细胞的化学和基因协同调控(来源:Angewandte Chemie )仰大勇课题组以生物大分子DNA为研究主线,聚焦DNA生物功能材料化学组装与智能制造,并用于生命分析和疾病治疗。
此次,课题组构筑了一种超分子自组装DNA纳米系统,通过化学和基因协同调控增强肿瘤细胞的氧化应激,实现了对肿瘤的高效抑制和治疗(图1)。
作者首先合成了两亲性碲醚(TeEG2),并与Mn(II)配位形成复合物(Te/Mn),Te/Mn与胆固醇修饰的DNA共组装生成具有类芬顿催化活性的DNA杂化纳米胶束。
锚定在纳米胶束表面的DNA作为引发链触发发卡DNA(H1和H2)进行级联钳式杂交链式反应(C-HCR),实现纳米胶束界面上的DNA网络动态组装。
发卡H2末端修饰ATP适配体,通过碱基互补配对与核酸药物siNrf2连接,实现siNrf2在DNA网络的高效负载。
TeEG2具有出色的σ供电子能力,可促进电子从Mn(II)到H2O2的转移,提高了Mn(II)对类芬顿反应的催化活性,在肿瘤细胞中产生大量高毒性∙OH,实现对肿瘤细胞的化学调控。
同时,在肿瘤细胞内ATP分子驱动下,DNA网络中的ATP适配体发生变构,实现siNrf2的特异性可控释放,下调转录因子Nrf2及其相关抗氧化酶的表达,实现对细胞的基因调控。
体外和体内实验均表明,基因调控可与化学调控协同作用显著增强肿瘤细胞的氧化应激,从而抑制肿瘤细胞的生长。
该工作报道的超分子自组装DNA纳米系统,为以肿瘤细胞氧化应激为靶标的治疗策略提供了重要的材料化学基础,有望推动精准医疗的发展。
来源:CBG资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247538491&idx=1&sn=5ab1f5abfee3be269895da192ddc263b
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
科学家用灵芝当妙药 “饿死”肿瘤细胞
癌症演化树:揭示癌症转移机制



辽宁省细胞生物学学会分子诊断专业委员会胸部肿瘤基层MDT学组成立大会暨辽沈胸部肿瘤多学科论坛在沈阳 召开
植物细胞器pH调控细胞生物学功能研究获进展
美揭示脑癌细胞长寿关键秘密

【活动预告】EMBO-CSCB Joint Webinar:细胞生物学研究前沿与论文发表
2017年全国植物细胞生物学大会顺利召开



停课不停学 《医学细胞生物学》变身线上精品课




国家纳米中心在肿瘤液体活检方面取得进展
重磅推荐!Plant Cell公布了植物细胞生物学15个最重要的问题