科技工作者之家
加好友
科技工作者之家 2021-10-08
HNRNPA2B1是oTau-c主要靶点,HNRNPA2B1为连接子,将寡聚tau(oTau)与N6-甲基腺苷(m6A)修饰的RNA转录本连接,称为N6-甲基腺苷RNA。
HNRNPA2B1下调可以防止oTau、oTau-c与m6A结合或减少蛋白质合成,减少tau纤维形成、核膜破坏和oTau诱导的神经退行性变。
2021年9月波士顿大学医学的Benjamin Wolozin团队在《Molecular Cell》发表关于tau与HNRNPA2B1和N6甲基腺苷RNA的相互作用介导tau病进展文章。
证实包含oTau、HNRNPA2B1和m6A的复合物,助于oTau综合应激反应。
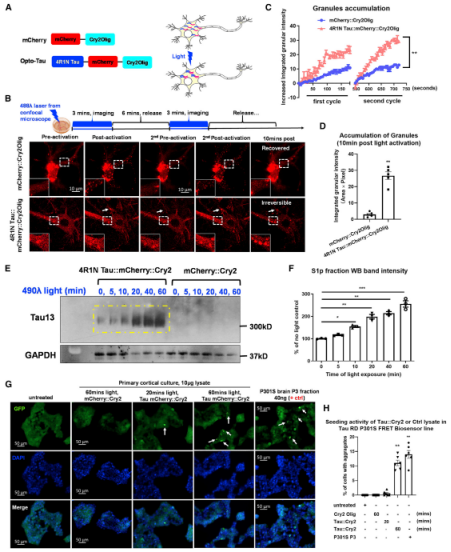
研究结果Cry2驱动初级皮质神经元tau寡聚作者首先创建tau::mCherry::Cry2Olig(tau::Cry2)和mCherry::Cry2Olig (mCherry::Cry2)嵌合体,将Tau::Cry2转到培养的初级皮层神经元时,光诱导有助于Tau::Cry2的大型细胞质内含物形成(图1A-D)。
将Tau::Cry2和mCherry::Cry2转导的神经元光照20或60min。
在60min光照下,Tau::Cry2的裂解液诱导传感器系的结实播种(图1G、H)。
长时间光照诱导tau蛋白从低聚态变为纤维态(图1F),Tau聚集物增殖,表现硫黄素S反应性。
图1:Cry2驱动初级皮质神经元tau寡聚Tau齐聚使疾病相关表位磷酸化和引起神经毒性光介导的tau寡聚诱导T181和S262磷酸化且tau蛋白磷酸化在表达tau::Cry2的神经元和邻近神经元中积累。
另外,皮质神经元培养用Tau::Cry2或mCherry::Cry2转导,20min/天×3天的光照,树突长度显著减少、形态异常和数量减少。
在光照4R1N Tau::Cry2和map-2阳性神经元中,神经元裂解caspase-3强度增加,表明促凋亡活性增加。
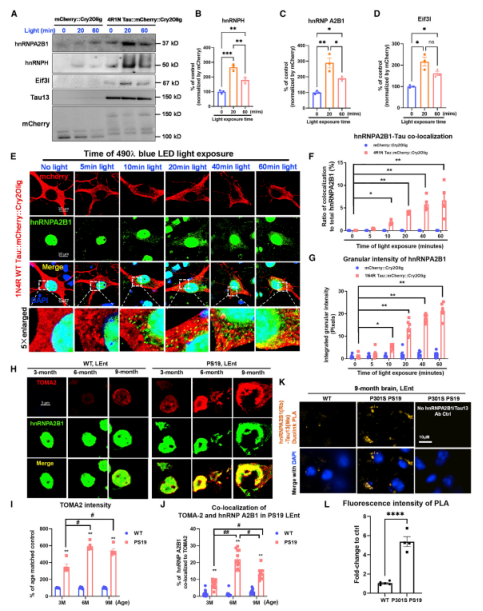
Tau寡聚引起核膜破坏和HNRNPA2B1的细胞质易位在PS19 P301S小鼠中,核膜的破坏明显。
与WT对照组或3个月PS19 P301S tau相比,6个月PS19 P301S tau小鼠oTau与laminB2的结合增加。
3个月时,LBR在PS19 P301S小鼠大脑的分布明显改变。
在6、9个月小鼠中,LBR分布异常丰富,仅部分与oTau共定位。
此外,HNRNPA2B1与体内外oTau和tau病理有关,同时pTau通过刺激tau寡聚增强与HNRNPA2B1的相互作用。
用抗HNRNPA2B1抗体标记皮质小鼠神经元,Tau寡聚化引发HNRNPA2B1核细胞质易位,并与oTau逐渐共定位(图2E-J)。
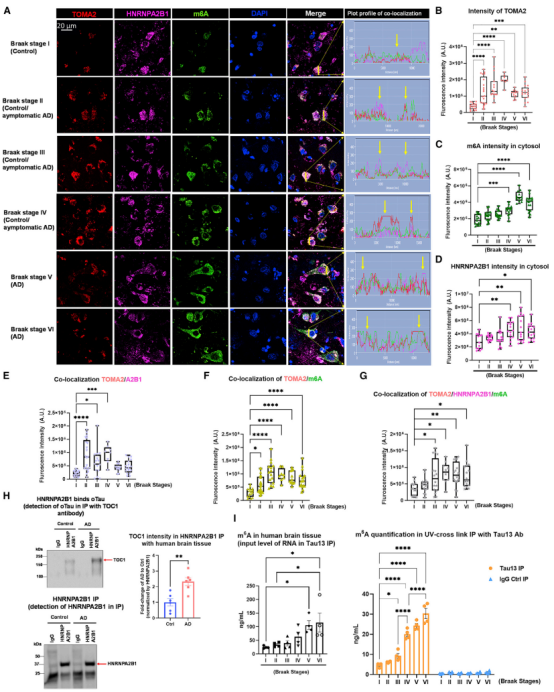
图2:Tau寡聚引起HNRNPA2B1定位显著变化 在人类AD中,HNRNPA2B1是oTau-c与m6A结合所必需在人类AD中,HNRNPA2B1是oTau-c与m6A结合所必需作者发现,晚期AD病例表现为细胞质m6A反应性且总反应性比对照组增加,tau、HNRNPA2B1和m6A共定位最强(图3A-G)。
此外,在AD中与HNRNPA2B1相关的oTau数量增加(图3H),与tau和HNRNPA2B1相关的m6A数量增加(图3I)。
HNRNPA2B1缺失导致oTau-c与m6A位点关联减少、反应活性丧失。
另外,HNRNPA2B1基因敲除显著减少PABP或EIF3h SGs的形成和部分挽救蛋白质合成。
图3:m6A在人AD中与tau寡聚物共定位HNRNPA2B1是tau介导的神经变性的关键蛋白作者发现,光诱导的oTau-c增加神经元的TUNEL反应性,HNRNPA2B1敲低降低TUNEL反应性(图4H-I)。
用siRNA处理HNRNPA2B1或Tau::Cry2表达神经元,光照20min/天×3天,在光照Tau:: Cry2神经元中,敲除HNRNPA2B1降低裂caspase-3反应活性(图4J-K),说明HNRNPA2B1在oTau-c诱导的神经毒性中发挥重要作用。
作者在P301S tau小鼠CA1区域注射含有HNRNPA2B1 shRNA的病毒或空载病毒,并在两周后注射oTau,三周后检查tau蛋白病理。
结果显示,注射oTau的小鼠显示明显的oTau、HNRNPA2B1和m6A病理。
注射AAV9 HNRNPA2B1 shRNA小鼠表现HNRNPA2B1敲减,同时oTau、m6A和裂解caspase-3的标记显著减少。
综上,应激可以诱导Tau寡聚化和磷酸化,从而引起细胞毒性,但是oTau的分子靶标仍然是未知的。
本研究中发现,oTau/HNRNPA2B1/m6A复合物在AD中增加,调控RNA翻译应激反应,促进应激颗粒的形成。
oTau持续积累导致不溶复合物形成和毒性,但敲除HNRNPA2B1可部分逆转毒性,抑制oTau与m6A转录本的关联和应激反应。
因此,作者提出模型去研究oTau如何在应激反应中发挥作用,并提出潜在的神经毒性机制和tau病药物治疗的假定靶点。
来源: brainnews
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649609616&idx=2&sn=bd96f8df5619ec8b4b70aff0fbe9e027
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

JAMA:粉样蛋白(A)、tau蛋白(T)和神经变性生物标志物与记忆下降
生物物理所揭示磷脂膜促进Tau蛋白聚集的单分子机制

南开大学曹雪涛团队揭示hnRNPA2B1识别病毒DNA并促进IFN-α/β产生
Cell :翻译后修饰介导tau蛋白致病性的分子结构多样性
皮克病tau蛋白纤维结构破解
tau蛋白上的又一个新修饰——琥珀酰化修饰

Nat Cell Biol:tau蛋白的“外套”结构和细胞骨架保护机制

EMBO Rep | 刘恭平、王建枝教授团队发现Tau蛋白聚集神经损伤的机制

Nature:揭示高盐饮食通过促进蛋白tau磷酸化损害大脑认知功能

研究进展:Nature-错误折叠Tau 蛋白的结构菌株定义了不同的疾病