科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-31
来源:两江科技评论
导读
近日,北京大学物理学院施可彬研究员和分子医学所陈良怡教授等人合作将三维无标记光学衍射层析显微成像与二维海森结构光超分辨荧光成像技术相结合,发展了超分辨荧光辅助衍射层析(SR-FACT)双模态显微成像技术,实现了对细胞内细胞器相互作用过程的高速三维全景成像。其中,光学衍射层析成像模态首次实现了活细胞内线粒体、脂滴、核膜、染色体、内质网及溶酶体等多种亚细胞结构的同时高速三维成像。在双模态系统对活细胞的观察中,他们发现了一种新的亚细胞结构,命名为“黑色液泡小体”,并对其在细胞代谢过程中的作用进行了研究。这一双模态成像方法在细胞生物学研究及生物医学成像领域有着广泛应用前景。相关成果以“Super-resolution fluorescence-assisted diffraction computational tomography reveals the three-dimensional landscape of the cellular organelle interactome”在线发表在国际光学高水平期刊《Light: Science & Applications》上。论文第一作者北京大学博士后董大山,博士后黄小帅和博士研究生李柳菊,通讯作者为陈良怡教授和施可彬研究员。
研究背景
超分辨荧光成像技术的出现极大的推动了现代生命科学对细胞内新结构和新的动态过程的研究。然而,受限于较宽的发射光谱及光毒性,其仅能对有限几种荧光标记同时成像,难以用于细胞内不同细胞器间复杂代谢过程的研究。电子显微镜虽然具有更全面及高分辨率的成像能力,但不能对活细胞进行动态成像。即使在活细胞的超分辨荧光成像中,依然也需面对荧光漂白效应对三维成像速度、成像总时程的限制。
无标记成像则不受荧光标记物引入的各种限制。无标记成像技术通过细胞内不同结构表现出的不同光学属性来进行成像,如以相衬显微镜为代表的各种相位成像方法可成像具有不同折射率的结构。新近出现的光学衍射层析成像通过结合断层扫描及全息显微成像技术,可在衍射模型下实现三维无标记成像。但先前的工作在关注提高光学衍射层析成像分辨率的同时,忽略了较慢的成像速度在活细胞成像中造成的分辨率下降的问题。同时,由于缺乏分子特异性成像模态作为对照,其三维成像结果缺乏说服力。
因此,亟需将无标记的光学衍射层析成像模态与超分辨荧光成像模态相结合用于活细胞成像,以同时实现细胞内全景的分子特异性成像。同时还需考虑到两个模态各自的特点,最大程度的提高成像速度,以适应快速、长时程成像的需求。
创新研究
在这项研究中,研究团队集成了三维光学衍射层析显微成像模态与海森二维结构光照明荧光成像模态,实现了对活细胞的快速、长时程双模态成像。在三维光学衍射层析成像模态中,研究团队发展了新的波矢迭代算法以修正高速的照明光断层扫描中出现的误差,以在保证高速成像的同时保持成像系统中充足的光子通量,从而有效提高了高速成像过程中的灵敏度,可以200 nm横向分辨率对40×40×20 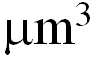 的三维视场以0.8 Hz速度成像。而对于超分辨荧光成像模态,研究团队选择了相比传统结构光照明荧光显微镜更加节约光子数的海森二维结构光荧光显微镜来辅助光学衍射层析模态进行分子特异性表征,其横向分辨率可达100 nm。利用这一双模态成像系统,研究团队成功对活细胞内六种主要细胞器进行了共定位成像,并展示了其在研究细胞器相互作用中的独特优势。研究团队还观察到了一种新的中性酸碱度的低折射率囊泡结构,并通过长达小时量级的连续成像揭示了其生成和命运路径及组织细胞器相互作用的枢纽功能,命名为“黑色液泡小体”。
的三维视场以0.8 Hz速度成像。而对于超分辨荧光成像模态,研究团队选择了相比传统结构光照明荧光显微镜更加节约光子数的海森二维结构光荧光显微镜来辅助光学衍射层析模态进行分子特异性表征,其横向分辨率可达100 nm。利用这一双模态成像系统,研究团队成功对活细胞内六种主要细胞器进行了共定位成像,并展示了其在研究细胞器相互作用中的独特优势。研究团队还观察到了一种新的中性酸碱度的低折射率囊泡结构,并通过长达小时量级的连续成像揭示了其生成和命运路径及组织细胞器相互作用的枢纽功能,命名为“黑色液泡小体”。
研究团队发展的这一双模态成像方法为全面三维的表征活细胞内细胞器相互作用及分子或信息的传递过程提供了一个有力工具。其有助于发现在单一成像模态中被忽略的结构或动态。由于低光毒性和无需特异标记的特点,这种成像方法未来将在生物学及医学中发挥重要作用。
图文速览
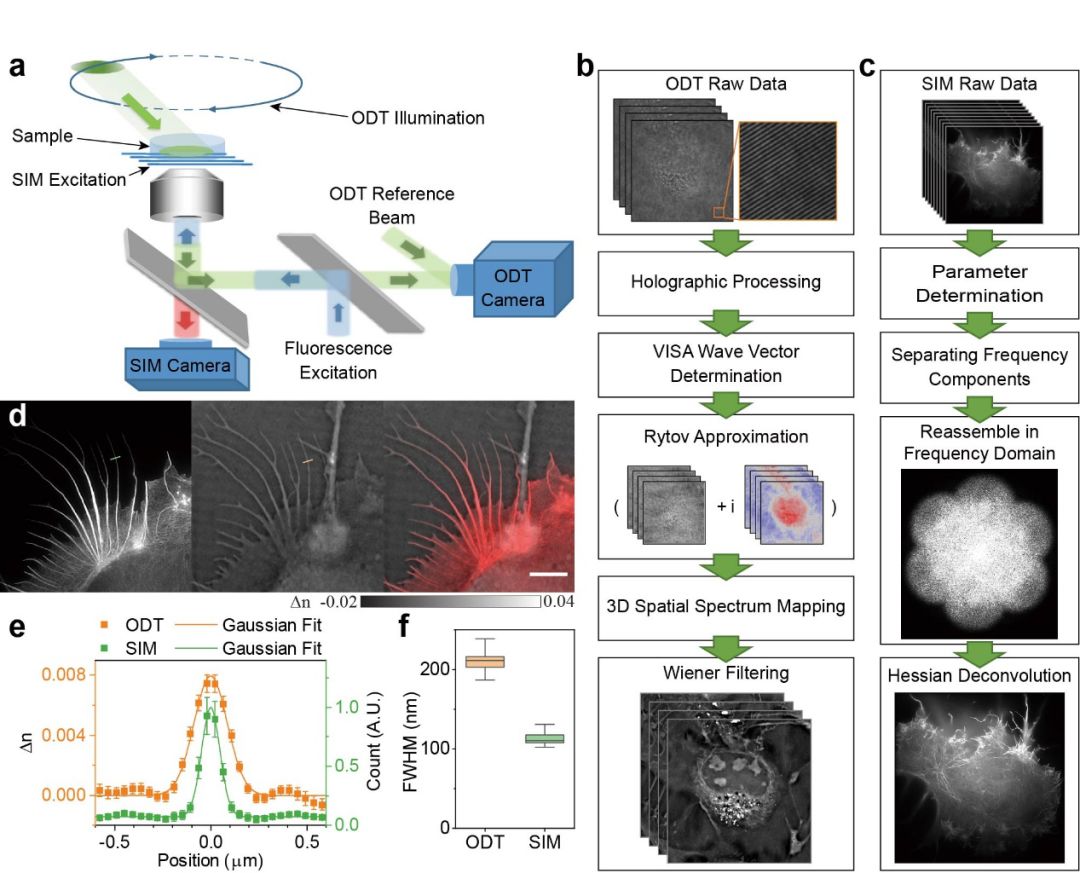
图1. SR-FACT双模态成像系统的硬件实现、算法流程及分辨率表征。
(a)SR-FACT硬件系统简图。光学衍射层析使用环状断层扫描,显微图像通过与参考光干涉形成离轴全息图测量。荧光成像模态通过形成具有特定方向条纹的结构光场激发荧光成像。
(b)光学衍射层析(ODT)模态重构算法流程。不同照明角度下的全息图像经过全息解算、波矢量迭代优化后通过Rytov近似在三维频谱空间拼接,逆滤波后得到三维折射率分布。
(c)结构光照明显微成像(SIM)模态重构算法流程。不同结构光照明角度下的荧光图像经过参数计算、频谱分离及二维频谱拼接后,通过海森解卷积算法得到超分辨率荧光图像。
(d)使用LifeAct-EGFP标记的COS-7细胞在SR-FACT下的成像结果。左侧为海森超分辨结构光照明荧光图像,中间为光学衍射层析成像的折射率分布,右侧为双模态融合图像。比例尺:5 μm。
(e)光学衍射层析模态及海森结构光照明荧光显微模态下沿着(d)中肌动蛋白纤维上的折射率和荧光强度分布。
(f)光学衍射层析模态及海森结构光照明荧光显微模态的横向分辨率评估结果。
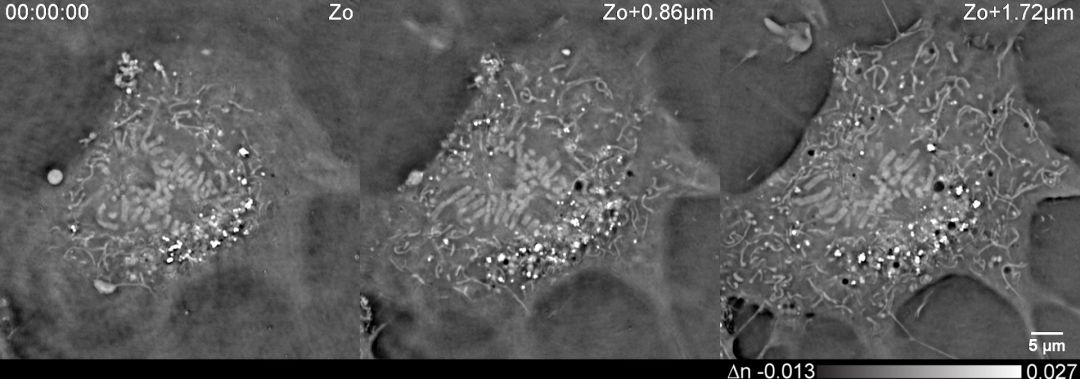
图2. COS-7细胞分裂过程的无标记光学衍射层析三维成像结果(视频)。

图3. 六种细胞器在SR-FACT下的共定位成像结果。
(a)KDEL-EGFP标记的内质网的共定位成像结果。
(b)MitoTracker Green标记的线粒体的共定位成像结果。
(c)LipidSpot 488标记的脂滴的共定位成像结果。
(d)LysoView 488标记的溶酶体的共定位成像结果。
(e)Lamin A-EGFP标记的核膜的共定位成像结果。
(f)H2B-EGFP标记的染色体的共定位成像结果。
右侧图像为左侧黄色虚线框所示区域的放大图像。比例尺:5 μm (左侧) 及 1 μm (右侧)。
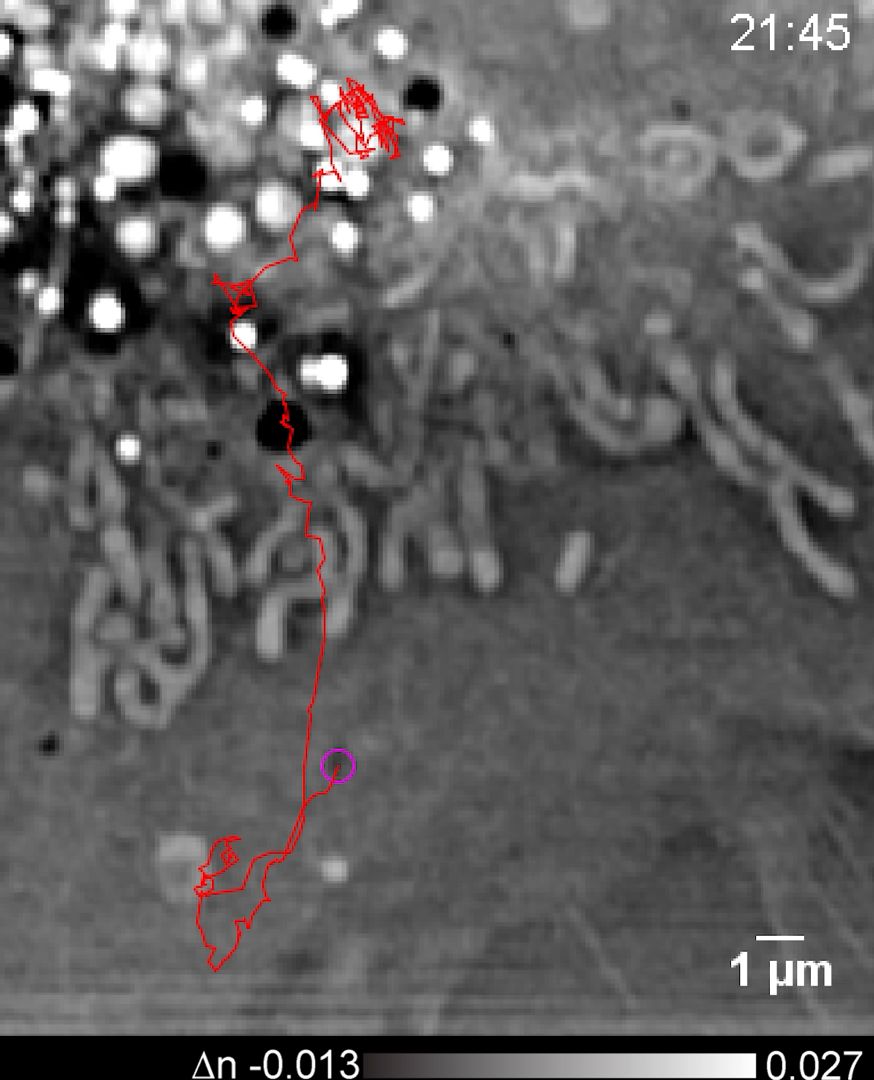
图4.黑色液泡小体在核周区域生成并最终与细胞膜融合的全过程(视频)。
总 结
该项工作得到国家自然科学基金(91750203、91854112、81925022、31521062、91850111、31901061、31327901),国家科技重大专项(2016YFA0500400、2017YFC0110203、SQ2016YFJC040028),北京市自然科学基金(L172003、7152079、5194026),国家博士后创新人才计划(BX201800008),中国博士后科学基金(2019M650329)和北京大学高性能计算校级公共平台的支持。
来源:imeta-center 两江科技评论
原文链接:http://mp.weixin.qq.com/s?__biz=MzU0NDgwMjI0MQ==&mid=2247490123&idx=1&sn=3e0c7d21141da31e305ca0ee350d1894&chksm=fb77cee5cc0047f3f5e529a0b7e60cf74f125fe0df5ebe69d7a015a92821f23033a6d0fce812&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

【纳米】高度有序的荧光蛋白纳米阵列:生物启发的人工光捕获系统

NBT : 杨弋/朱麟勇团队开发Pepper拟荧光蛋白RNA

【论文精选】基于绿色荧光蛋白的冷鲜猪肉中大肠杆菌预测模型的构建

【分析】Angew. Chem.:LipoFRET——绘制膜蛋白跨膜轨迹
诺奖得主Martin Chalfie:让绿色荧光蛋白点亮生物学研究之光

大连化物所等发现光诱导电子转移影响荧光染料发光强度的量化关系

徐涛课题组报道新型荧光蛋白
科学家建立基于膜透过荧光蛋白的邻近细胞标记技术
荧光蛋白的发色团及β桶结构

【经典演讲】钱永健教授:荧光蛋白的发现历程