科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2023-04-10
m6A是目前已知的真核细胞mRNA上最常见的一类化学修饰,其建立、读取和擦除分别受到相应甲基化酶(writer)、结合蛋白(reader)以及去甲基化酶(eraser)的动态可逆调控。研究表明,m6A能够通过调节mRNA的剪接、出核、稳定性及翻译等生命周期活动,参与调控机体的诸多生理或病理进程,包括胚胎发育、肿瘤及神经退行性疾病的发生等。然而,在生理性衰老过程中,m6A对于器官稳态维持的调控作用与关键分子机制均有待阐明。
4月6日,中国科学院动物研究所刘光慧研究组和曲静研究组联合北京基因组研究所慈维敏研究组和张维绮研究组,在《自然-衰老》(Nature Aging)上,在线发表了题为m6A epitranscriptomic regulation of tissue homeostasis during primate aging的研究论文。该研究利用非人灵长类动物(食蟹猴)生理性衰老的多器官研究模型,同时结合基于基因编辑和人类干细胞定向分化的研究体系,通过系统绘制器官和细胞衰老过程中RNA m6A修饰的动态图谱,解析了RNA甲基化修饰及相关基因表达稳态的变化规律,并探索了METTL3–m6A–NPNT通路调控骨骼肌衰老的新型机制。
本研究通过对年轻和年老食蟹猴的肝脏、骨骼肌和心脏进行系统的组织学分析发现,脂肪蓄积增加、炎症因子上调以及核纤层蛋白Lamin B1下调是三种组织衰老的共性特征;研究还发现骨骼肌中的凋亡细胞增加、肌纤维萎缩以及心脏中的心肌纤维肥大等组织特异的衰老相关退行性变化。进一步,通过联合分析三种组织的m6A表观修饰图谱及相应的转录组图谱,研究揭示了m6A修饰和基因表达稳态之间的相关性以及不同组织共性和特性的衰老调控规律。相较于肝脏和心脏,研究在骨骼肌中特异性地检测到整体m6A修饰的减少以及核心甲基化酶METTL3表达水平的降低。进而通过CRIPSR/Cas9技术,研究建立了由人类胚胎干细胞衍生的METTL3敲除的肌管细胞,发现METTL3的缺失导致肌管细胞发生萎缩、凋亡以及加速衰老等退行性变化,与衰老骨骼肌的表型一致。进一步的机制研究表明,NPNT作为METTL3的下游效应因子发挥维持骨骼肌细胞稳态的作用,而慢病毒载体介导的METTL3或NPNT回补表达均能一定程度上延缓人类肌管细胞的衰老。通过METTL3酶活抑制剂处理以及METTL3酶活突变体过表达等相关实验,研究证实了METTL3通过m6A催化活性依赖的方式促进NPNT的表达以及维持肌管细胞的稳态,并发现m6A结合蛋白IGF2BP1可以结合并稳定受到m6A修饰的NPNT mRNA。
综上所述,该研究揭示了三种重要的灵长类器官/组织在生理性衰老过程中的动态m6A修饰变化及其与基因表达稳态的关系,并阐释了METTL3–m6A–NPNT通路维持人类骨骼肌稳态的作用和机制。该成果深化了科学家对m6A参与维持人类器官功能稳态的认识以及对衰老的表观转录调控机理的理解,为探究骨骼肌衰老提供了有效整合灵长类器官模型和人类干细胞衍生物体系的系统性平台,并为延缓骨骼肌衰老或治疗与年龄相关的骨骼肌退行疾病(如肌少症)提供了潜在的分子靶标和干预策略。
该工作由动物所、北京基因组所、中科院干细胞与再生医学创新研究院、首都医科大学宣武医院等合作完成。研究工作得到科技部、国家自然科学基金和中科院等的支持。
论文链接
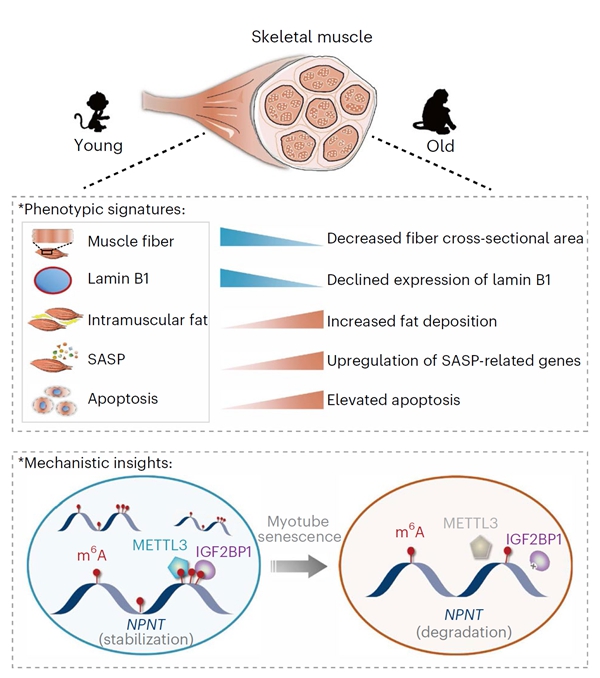
METTL3-m6A-NPNT通路调控灵长类骨骼肌衰老

METTL3通过RNA m6A修饰调控衰老
来源:中国科学院
原文链接:http://www.cas.cn/syky/202304/t20230410_4883454.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
【科技前沿】谢黎炜团队发现骨骼肌衰老新机理,为骨骼肌衰老的早期预防和干预提供新靶点和新思路
气候变化将带七种惊人影响,人类性生活或减少



骨骼肌

人类和鲨鱼的共同祖先生活在4亿4千万年前

m6A甲基转移酶METTL3在棕色脂肪组织出生后发育和能量消耗中的重要功能机制

刘鹤:推动全球机器人领域开放合作发展,更好造福人类社会

中国海洋湖沼学会理事张奇研究员主持的《鄱阳湖水文情势变化研究》出版发行

最新数据显示,人类或已达到身高、寿命等生物学极限

非编码RNA调控骨骼肌发育研究取得进展
Nature:脂肪酸控制骨骼肌干细胞再生