科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-02-20
来源:科技日报
科技日报记者 刘园园 通讯员 冯怡
记者20日从西湖大学获悉,西湖大学周强实验室利用冷冻电镜技术成功解析2019新冠病毒的受体——ACE2的全长结构,研究报告在预印版平台bioRxiv上线。这是西湖大学承担的浙江省新型冠状病毒肺炎防治应急科研攻关任务的重要成果。
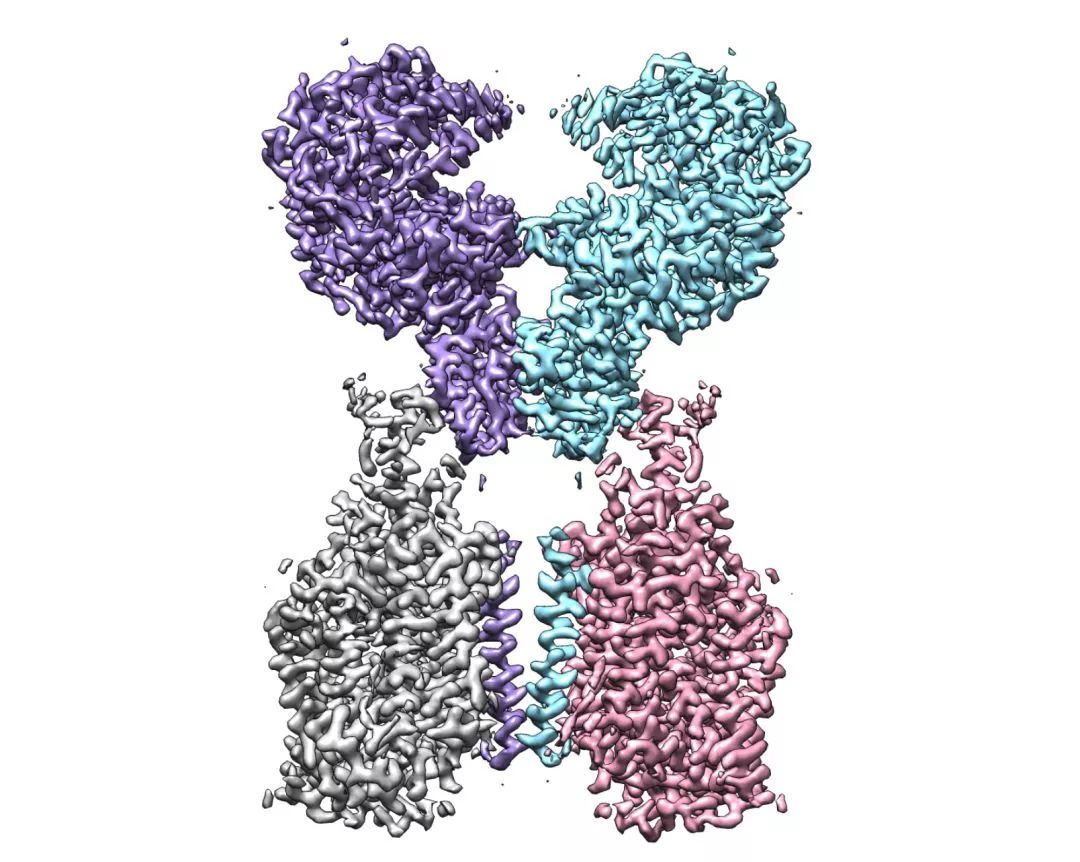
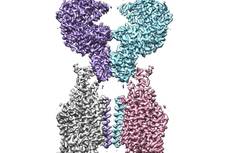
ACE2-B0AT1复合物的冷冻电镜密度图
新冠肺炎疫情爆发后,有研究发现,2019新冠病毒和SARS病毒一样,也通过识别位于人体肺部上皮细胞表面的ACE2蛋白进入人体细胞。新冠病毒在侵入人体的过程中,ACE2就像是“门把手”,病毒通过刺突蛋白(S蛋白)抓住它,进而打开进入细胞的大门。可以说,ACE2是新冠病毒侵入人体的关键。
最近,美国得克萨斯大学奥斯汀分校的研究团队展示了新冠病毒S蛋白的结构。然而,ACE2在细胞膜上以什么状态存在?新冠病毒相较于SARS病毒与ACE2结合有何异同?获取ACE2的全长蛋白及其与S蛋白的复合物结构,将大大有助于解答上述疑问。

西湖大学生命科学学院研究员周强(右)与西湖大学生命科学学院博士后鄢仁鸿(左)
周强实验室针对这个问题进行了攻坚。这项研究首先需要获取ACE2蛋白全长蛋白,但ACE2作为膜蛋白很难在体外稳定获得。周强及博士后鄢仁鸿通过共表达的方法获得了ACE2与肠道内一种氨基酸转运蛋白的优质稳定的复合物,之后利用西湖大学的冷冻电镜平台成功解析了其三维结构。
通过分析ACE2的全长蛋白结构,周强实验室发现,ACE2以二聚体形式存在,同时具有开放和关闭两种构象变化,但两种构象均含有与冠状病毒的相互识别界面。
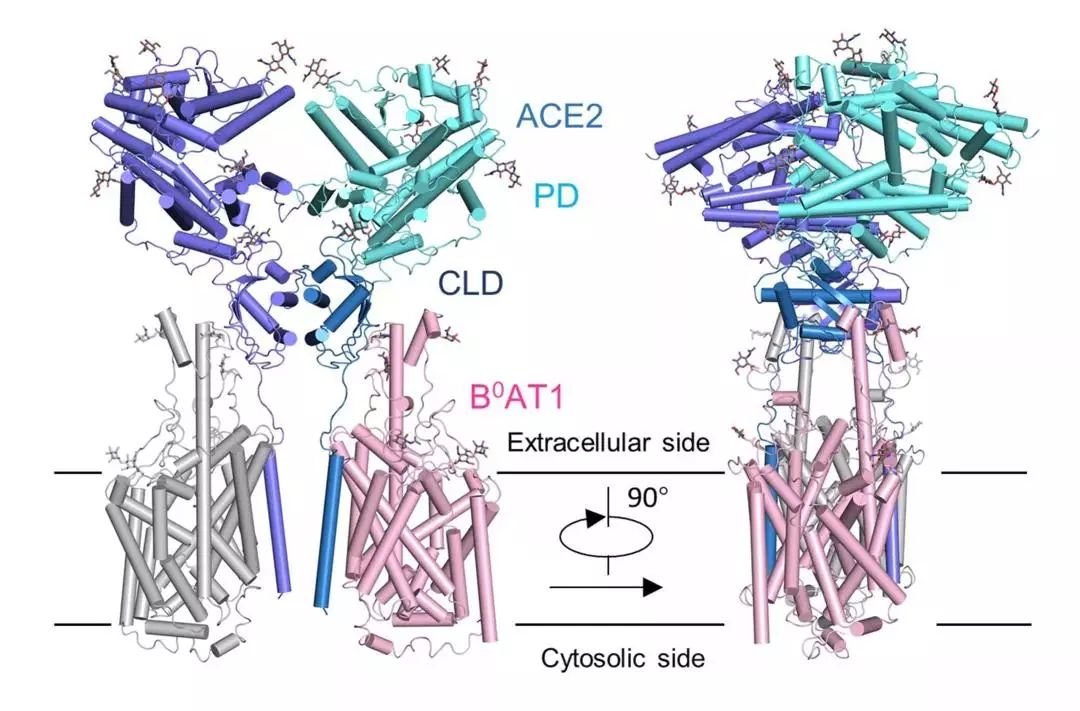
图片说明:ACE2-B0AT1复合物结构图
这项研究为进一步解析全长ACE2和新冠病毒的S蛋白复合物的三维结构奠定了基础。同时也为理解新冠病毒侵染细胞提供了很多有价值的线索。
比如,ACE2的二聚体与新冠病毒S蛋白的三聚体是否可以发生更高层级的交联,从而促进病毒与宿主细胞膜的融合或者内吞?这些通过结构研究揭示的问题,有待未来多学科探索。
“总体而言,ACE2全长结构的解析,将有助于理解冠状病毒进入靶细胞的结构基础和功能特征,对发现和优化阻断进入细胞的抑制剂有重要作用。”清华大学全球健康与传染病研究中心主任张林琦教授评价说。
来源:kjrbwx 科技日报
原文链接:http://mp.weixin.qq.com/s?__biz=MzI3NDI5MjI4OQ==&mid=2247540792&idx=3&sn=535c67a3897be70cc3d9411f1cb1ae25&chksm=eb142b16dc63a20029abe163cbf069b8a4c73ec19e1b11ecfad12e66d0db26d83290a16a0cda&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
亚油酸能进入口袋阻止S蛋白与ACE2的结合,抑制病毒复制
第七届全国微生物遗传学学术研讨会圆满结束

全球首次!西湖大学成功解析出新冠病毒细胞受体ACE2全长结构

同济大学左为团队:新型冠状病毒男性亚裔标本的ACE2表达水平远高于其它所有人!
Science : 世界首次!西湖大学成功解析出新冠病毒细胞受体ACE2全长结构
科睿唯安数据分析与评估业务总监Di Cross博士访问国家科技...
世界首次!西湖大学成功解析出新冠病毒细胞受体ACE2全长结构

ACE2受体蛋白“纳米气泡”可防治新冠
第二届植物开花、衰老与采后生物学学术研讨会成功举办
《自然》:揭示新冠病毒刺突蛋白结合人ACE2受体的结构机制