科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-02-23
来源:BioArt
人类免疫缺陷病毒(HIV)是一种能攻击人体免疫系统的病毒,主要感染并破坏CD4+T淋巴细胞。大量研究发现,HIV感染者体内多种细胞,包括单核细胞、树突状细胞、NK细胞、天然免疫T细胞等免疫功能缺失或降低,导致机体不能有效清除HIV病毒。特别是近年来研究提示,HIV慢性感染时,机体多个淋巴器官和淋巴组织(包括肠道、骨髓、淋巴结等)的区域免疫能力大幅受损,并对机会性感染的防御能力大大降低。然而,HIV诱导的区域免疫损伤机制尚不甚清楚,目前在临床上还缺乏靶向机体区域免疫的治疗策略和手段。
国家感染性疾病临床医学研究中心(深圳市第三人民医院/南方科技大学第二附属医院)张政课题组前期发现:在HIV慢性感染中,浆样树突细胞(plasmacytoid dendritic cells, pDCs)被激活并进一步产生较高水平I型干扰素(Type I Interferon, IFN-I),从而触发一系列淋巴器官和组织免疫高活化和免疫病理损伤【1, 2】。近期,该团队利用HIV-1感染者组织标本库和人源化小鼠模型,进一步阐明了HIV感染可激活pDC/IFN-I上调体内(尤其是肠道)天然淋巴细胞(innate lymphoid cells, ILCs)Fas/FasL信号、并诱导其凋亡;删除pDC或阻断IFN-I可明显减少ILC1和ILC3凋亡并恢复其功能,进而恢复肠道粘膜免疫屏障功能【3, 4】。该团队还鉴定了CD4+ ILC1新亚群,并发现它是HIV储藏库细胞,为消除HIV储藏库提出了新的治疗靶点【4】。他们还发现,激活的pDC/IFN-I可引起骨髓造血干细胞(hematopoietic stem cells,HSCs)功能损伤【5】。
2020年2月19日,南方科技大学第二附属医院(深圳市第三人民医院)张政团队在Science Advances发表题为 Sustained IFN-I Stimulation Impairs MAIT Cell Responses to Bacteria by Inducing IL-10 during chronic HIV-1 Infection 的文章。该研究阐明了HIV感染中IFN-I的免疫致病新机理,为研发阻遏HIV感染者体内MAIT细胞功能、降低HIV感染者易感结核提供了新的策略和科学手段。

粘膜相关恒定T(Mucosal associated invariant T, MAIT)细胞是一类进化保守的天然免疫T细胞,表达半恒定T 细胞受体(T cell receptor, TCR)Vα7.2-Jα33链。不同于识别特异性肽类抗原的传统T 细胞,MAIT细胞能够识别I 类主要组织相容性复合体相关分子(major histocompatibility complex class I -related molecule, MR1)限制性呈递的、细菌源性的维生素B 类代谢产物,并发挥生物学功能。MAIT细胞参与了人体对抗感染性病原体的免疫防御过程,同时还调控着多种炎症反应性疾病的病理过程。HIV感染也会导致机体MAIT 细胞数量减少和功能降低,其机制尚不明确。
该研究团队首先证实HIV慢性感染外周MAIT细胞数量减少、对抗细菌的功能显著降低。那么,HIV感染是通过何种因子损伤了MAIT细胞功能呢?首先,该团队利用单细胞测序技术(single-cell RNA sequencing, scRNA-seq)解析了HIV感染者和健康对照外周血CD3+ T细胞转录组图谱,以期发现HIV感染者MAIT细胞功能损伤的关键影响因子。通过对比,该团队发现HIV感染者外周血MAIT细胞共刺激分子(PD-1,Tim3等)和干扰素诱导基因显著上调。通过体外实验,该团队进一步证实:体外阻断上述共刺激分子并不能恢复HIV感染患者MAIT细胞功能,而IFN-α预处理则显著损伤了MAIT细胞的抗菌功能。
是IFN-I直接诱导MAIT细胞损伤的吗?该团队通过一系列细胞删除实验,发现:IFN-I预处理可诱导单核细胞产生大量IL-10,后者进一步抑制其分泌IL-12,从而引起MAIT细胞共刺激信号IL-12减弱,最终导致其抗菌免疫功能损伤;而体外阻断IFN-I或阻断IL-10均可显著恢复受损的MAIT细胞抗菌功能。最后,该研究团队进一步在HIV感染模型进一步证实了上述现象,并发现IFN-I介导的MAIT细胞功能损伤是不能有效清除结核杆菌的关键原因。上述结果阐明了HIV感染中IFN-I的免疫致病新机理,为研发阻遏HIV感染者体内MAIT细胞功能、降低HIV感染者易感结核提供了新的治疗策略。
综上所述,该研究团队通过系列研究证实:pDC/IFN-I通路激活是HIV感染引起淋巴组织区域免疫损伤(包括肠道、骨髓等)的关键“扳机点”,提出了“体内阻断IFN-I或IL-10是恢复上述重要脏器免疫功能”的新的治疗策略(见下图)。
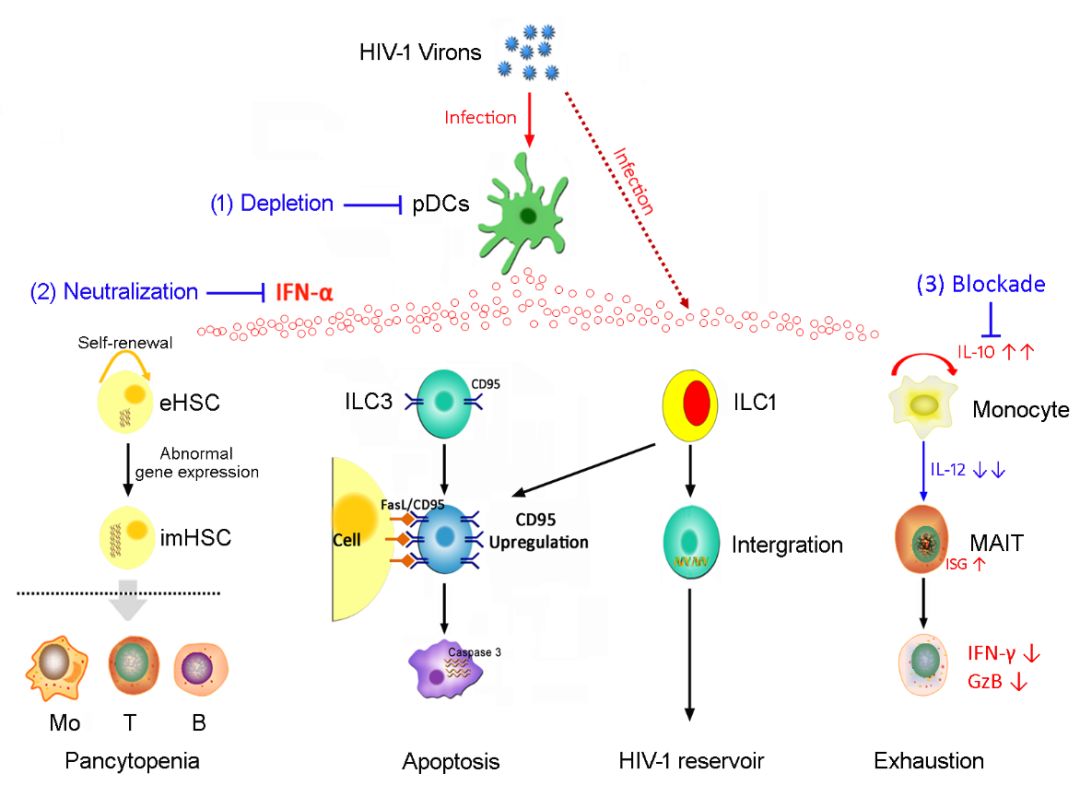
HIV感染pDC/IFN-I免疫致病机理及干预策略
南方科技大学第二附属医院(深圳市第三人民医院)唐娴助理研究员、上海市公共卫生中心章术业教授、深圳市第三人民医院感染科彭巧丽以及香港大学凌理军为本文的共同第一作者,张政教授为本文通讯作者。
张政教授团队近年来与美国北卡罗来纳大学教堂山分校苏立山教授、解放军第五医学中心王福生院士、中国科学院生物物理研究所张立国教授合作,聚焦HIV慢性感染IFN-I的免疫致病机理和HBV慢性感染炎症损伤进行了系列的研究工作,在Sci Adv (2020), J Leu Bio (2019), Plos Pathog (2017, 2018), J Clin Invest (2015), Hepatology (2015) , Cell Mol Immunol (2015) 等期刊发表了系列论文。本项研究代表了该方向的最新进展。
原文链接:https://advances.sciencemag.org/content/6/8/eaaz0374参考文献
1. Zhang Z, et al. Differential restoration of myeloid and plasmacytoid dendritic cells in HIV-1-infected children after treatment with highly active antiretroviral therapy. J Immunol, 2006, 176(9):5644-5651
2. Zhang Z, et al. BTLA down-regulation by HIV-1 depends on type I interferon and contributes to T cell hyper-activation. J Infect Dis, 2011, 203(11), 1668-1678
3. Zhang Z, et al. Plasmacytoid dendritic cells promote HIV-1-induced group-3 innate lymphoid cell depletion. J Clin Investig, 2015, 125(9):3692–3703. Commentary on J Clin Invest. 2015, 125(9):3430–3432
4. Zhao J, et al. Infection and depletion of CD4+ group-1 innate lymphoid cells by HIV-1 via type-I interferon pathway. PLoS Pathog. 2018, 14(1): e1006819
5. Li G, et al. HIV-1 infection depletes human CD34+CD38- hematopoietic progenitor cells via pDC-dependent mechanisms. PLoS Pathog. 2017 Jul 31;13(7):e1006505.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652481389&idx=4&sn=4825e153b85a9f91b9d5b7b3ce7a89fd&chksm=84e234d9b395bdcfd0ae2ae27f3f1a82493db68a9764332c3eeef64bc9a76292d68f152eedb3#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

世界首例HIV-HIV肾脏移植
关于细胞免疫疗法



罹患新冠会损伤大脑认知功能
HIV感染抑制剂可提供长期保护
单细胞水平肺癌T细胞免疫图谱绘就

Cell : 抑制HIV-1感染的新型中和抗体
世界首例!艾滋病患者活体肾移植成功,此刻起HIV病人也能挽救更多生命
Science子刊:南科大张政团队揭示HIV慢性感染MAIT细胞功能损伤新机制

抓住降低HIV感染的黄金72小时
HIV病毒可以藏身大脑,日后感染其它器官