科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-16
来源:中国生物物理学会
CRISPR-Cas9系统在基因编辑领域具有划时代的意义,并被广泛用于基础研究和临床应用研究。其发挥基因编辑的基本原理是,Cas9蛋白与sgRNA形成复合物切割靶位点引入DNA双链断裂(DSBs),之后由非同源重组修复(NHEJ)途径诱导插入缺失突变,或在DNA修复模板的存在下通过同源重组修复(HDR)途径实现精准基因编辑。然而,作为外源性过表达的核酸酶,Cas9很可能有潜在的安全风险。2018年,有研究者指出,CRISPR系统能激活p53而引发DNA损伤(详见BioArt报道:两篇Nat Med致CRISPR股票大跌,这回是因为p53)【1,2】,之后研究者还发现,CRISPR-Cas9还会在DSBs位点停留而导致大片段缺失乃至各种复杂的染色体结构异常(详见BioArt报道:NBT丨CRISPR编辑技术面临新的安全隐患——胡家志点评)【3】。由此可见,CRISPR-Cas9系统的安全性仍需进一步评估。
2020年3月14日,来自中山大学第八附属医院、深圳市儿童医院的付雪梅实验室与南方医科大学肿瘤研究所徐洋实验室合作在Protein&Cell杂志上发表了题为CAS9 is a genome mutator by directly disrupting DNA-PK-dependent DNA repair pathway的论文。文章发现了Cas9引发DNA损伤的新机制。研究指出,在没有外源sgRNAs的条件下,Cas9蛋白依然可直接结合DNA-PK复合物中的KU86亚基,进而抑制DNA-PK复合物依赖的NHEJ修复通路引发DNA损伤。研究还发现,Cas9突变体xCas9和dCas9能通过相同的机制引发DNA损伤。这提示我们,CRISPR-Cas9系统的安全性仍有待进一步提高。

之前研究者多关注sgRNA存在的条件下,CRISPR-Cas9系统存在的安全隐患,Cas9蛋白本身对基因组稳定性的影响依然缺少研究。本文中研究者首先构建出Dox诱导的条件性表达Cas9的人胚胎干细胞系(hESCs)模型,并在此基础上分析Cas9蛋白对基因组稳定性的影响。结果发现,Cas9过表达能激活DNA损伤应答通路,诱导DSBs标志物——γH2AX焦点的形成(图1);彗星实验也证实,Cas9本身便可诱导DSBs损伤,进而激活p53下游靶基因的表达而导致hESCs的死亡和分化。研究者还在人诱导多能干细胞(hiPSCs)和人成纤维细胞中证实了Cas9诱导DSBs损伤激活DNA损伤应答通路的能力。研究还发现, Cas9诱导DSBs损伤的能力与剂量无关,低剂量的Cas9蛋白便足以引发DNA损伤。
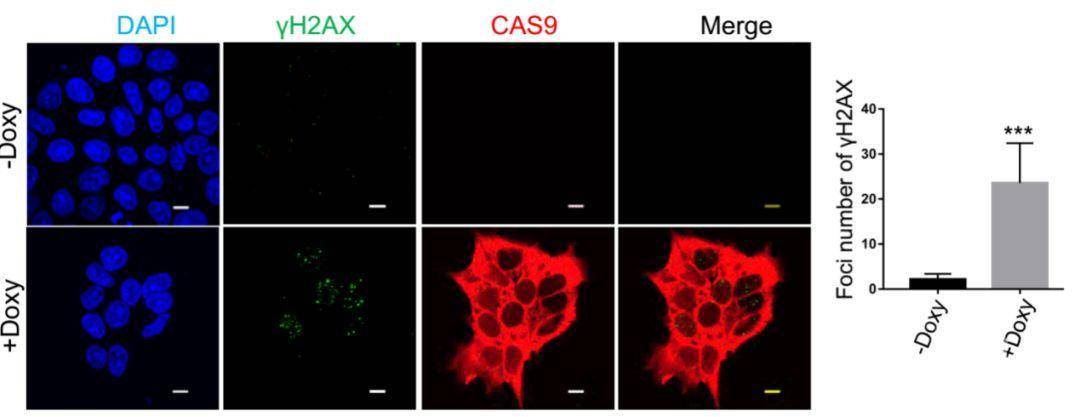
图1 Cas9过表达诱导γH2AX焦点形成
为探究Cas9诱导DSBs损伤的机制,研究者通过蛋白免疫共沉淀对其相互作用因子进行了分析,结果显示,Cas9蛋白能通过C末端结构域直接结合KU86 而破坏DNA-PK复合物的形成。考虑到DNA-PK复合物是NHEJ修复通路的关键因子,研究者进一步分析了Cas9过表达对DSBs损伤后修复通路的影响,结果显示,Cas9过表达能明显抑制NHEJ修复通路的进行,而对HDR修复通路影响甚微。
最后研究者还发现,Cas9的高保真突变体xCas9及失活体dCas9同样能结合KU86破坏DNA-PK复合物的形成,干扰NHEJ修复通路的进行,最终导致DNA损伤和基因组不稳定性。
总体而言,本研究通过一系列实验证实,Cas9及其各种突变体能直接结合DNA修复通路的关键因子KU86,干扰DNA-PK复合物的形成,抑制NHEJ修复通路介导的DNA损伤修复,导致DNA损伤和基因组不稳定性。本研究提醒我们,研究者对CRISPR-Cas9系统安全风险的认识仍有不足之处,在开展相关的临床研究时还须保持谨慎态度。
原文链接:
https://link.springer.com/article/10.1007/s13238-020-00699-6
参考文献
1. E. Haapaniemi et al., CRISPR-Cas9 genome editing induces a p53-mediated DNA damage response. Nat Med, (2018).
2. R. J. Ihry et al., p53 inhibits CRISPR-Cas9 engineering in human pluripotent stem cells. Nat Med, (2018).
3. Michael Kosicki et al., Repair of CRISPR–Cas9-induced double-stranded breaks leads to large deletions and complex rearrangements. Nat Biotechnol, (2018).
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
微信号:BSC-1979

来源:BSC-1979 中国生物物理学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4NjE1NTQ5Mg==&mid=2649499345&idx=2&sn=cf6be058e31cf742742a7433cd054d11&chksm=87d58f5ab0a2064ce1960665a08547da00aef09e3dc23a964eab421c348b56c63c113d2b6a1d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
新型光敏CRISPR-Cas9系统实现基因编辑的光调控

DNA到底能不能预测外貌?
非对称聚合物材料可制造灵活多变的软机器人

生物物理所等揭示anti-CRISPR沉默CRISPR-Cas9系统的分子机理

Cell:科学家发现首个小分子抑制剂,给CRISPR-Cas9戴上紧箍咒

王艳丽组揭示anti-CRISPR沉默CRISPR-Cas9系统的分子机理
意外突变!CRISPR-Cas9应用依旧任重道远

Mol Ther:科学家有望利用CRISPR-Cas9技术成功治疗宫颈癌

新研究揭开人类头发曲直的秘密

夫妻相真的存在,研究发现夫妻DNA相似度高过陌生人