科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-16
来源:BioArt
一个卧底在DNA甲基化酶家族中的RNA甲基化酶
在DNA甲基化,RNA甲基化以及表观遗传调控方面的功能研究和发现经历了不少曲折,延伸出不少意外的有趣发现以及新的研究方向。在过去20多年中,对Dnmt2的研究工作经历了一个困惑期(认为它是DNA甲基化酶)、顿悟期(揭示它对tRNA特定位点甲基化的功能以及对tsRNA生成的影响)、以及目前正在进行的扩展期(对细胞/个体stress的调控,以及在RNA介导的获得性性状跨代遗传中的作用)。
鉴于Dnmt2所属的其他Dnmt家族成员(DNA(cytosine-5)-methyltransferase)在DNA甲基化及表观遗传领域的重要作用,我们也在这里简略介绍一下其他Dnmt家族成员的研究简史,其中涉及哥伦比亚大学的Timothy H.Bestor(表观遗传学家徐国良院士的博后导师)和MIT的Rudolf Jaenisch(致敬Rudolf Jaenisch丨转基因工程小鼠的四十六载)等著名实验室和他们的嫡系实验室,以及一些相关领域做出杰出贡献的华人科学家实验室。
早在上世纪80年代,Jaenisch实验室就发现经甲基化(m5C)的DNA转染细胞后无法转录表达,而去除m5C后则可以恢复表达,从而提出DNA甲基化可能调节真核生物基因转录的观点(PNAS,1981)【1】。Bestor实验室是研究DNA甲基化酶的先驱,克隆了真核生物的第一个DNA甲基化酶(PNAS,1983)【2】,后来被命名为DNMT1(DNA(cytosine-5)-methyltransferase 1)。
1992年,Bestor和Jaenisch实验室合作(一作者是华人科学家李恩),在小鼠中敲除DNMT1基因后发现Dnmt1缺失导致DNA甲基化水平大量降低到正常水平的~30%,并导致胚胎期死亡(embryonic lethal)(Cell,1992)【3】。随后Bestor实验室证明DNMT1缺失导致转座子(transposon)大量激活,进一步证明了DNA甲基化抑制转座子表达这一结论(Nat Genet,1998)【4】。目前认为Dnmt1的主要功能是对DNA甲基化的维持(maintenance)起关键作用。
Jaenisch实验室通过利用Dnmt1敲除鼠也进一步证明了印记基因(gene imprinting)现象的本质是DNA甲基化,一作者也是华人科学家En Li(Nature,1993)【5】。
注:Gene imprinting现象是Azim Surani(Nature,1984)【6】和Davor Solter(Cell,1984)【7】发现的,随后Surani实验室的博士后Wolf Reik(现在也是著名大咖)通过分析随机插入的transgene片段的DNA甲基化模式后,推测gene imprinting的本质是通过DNA甲基化起作用(Nature,1987)【8】。值得一提的是,时隔30年后,著名华人科学家Yi Zhang实验室最近又发现了不依赖于DNA甲基化,而依赖于母源H3K27me3的gene imprinting方式(Nature,2017)【9】。
另外,Jaenisch实验室通过DNMT1敲除模型还证明了DNA甲基化是控制X chromosome inactivation(雌性两条X染色体的其中之一失去活性的现象)的机理(Gene Dev,1995;Gene Dev,1996)【10,11】。
Dnmt1敲除后仍然有部分DNA甲基化存在的现象也提示还有其他的DNA甲基化酶。随后当时在哈佛大学的李恩实验室(现为上海诺华制药(NIBR)的head)证明Dnmt3a和Dnmt3b对小鼠胚胎的重新DNA甲基化(De Novo DNA Methylation)具有重要作用,敲除鼠表型也是胚胎期死亡(Cell,1999)【12】。
2001年,Bestor实验室发现另一个DNMT相关家族成员,Dnmt3L,也参与DNA重新甲基化,并发现敲除鼠中母源印记基因的甲基化丢失(Science,2001)【13】(徐国良老师当时在Bestor实验室,也参与了这项工作);以及Dnmt3L在精子发生过程中通过De novo甲基化对transposon的抑制有重要作用(Nature,2004)【14】。
由于Dnmt3L不具备甲基化催化活性的结构域,顾推测其可能作为其他de novo甲基化酶的co-factor起作用,后来在美国的华人科学家程晓东(中科院生物物理研究所所长许瑞明研究员90年代在美国冷泉港实验室的合作导师)实验室和德国的Albert Jeltsch实验室合作共同证明Dnmt3L和Dnmt3a通过形成复合体一起介导De novo甲基化(Nature,2007)【15】。11年之后,加州大学河滨分校的华人科学家Jikui Song实验室进一步获得了高分辨率的DNMT3a-DNMT3L-DNA复合体结构,在分子水平加深了对DNA de nove甲基化过程的理解(Nature,2018)【16】。
同在2007年,Bestor实验室与程晓东实验室的另一项合作研究表明DNMT3L可以一方面选择性地与组蛋白甲基化H3K4结合,同时可以与Dnmt3形成复合体(Nature,2007)【17】。这个里程碑式的研究第一次把组蛋白甲基化marker与DNA de novo甲基化联系了起来,也在一定程度上解释了DNA的de novo甲基化如何在组蛋白修饰的指导下在genome上选择特异的位置(组蛋白修饰领域的大牛David Allis也参与了这项研究)。
值得一提的是,Bestor的学生Déborah Bourc'his(Dnmt3L两项重要工作的一作者(Science,2001;Nature,2004)【13,14】在成立自己的实验室之后,最近又在小鼠雄性生殖细胞中发现了Dnmt3c(之前认为是一个假基因)介导的DNA甲基化对抑制young transposon的活性至关重要,敲除后导致雄性不育(Science,2016)【18】。
讲了一大堆,以上的研究都是Dnmt家族成员对DNA甲基化研究的故事,现在我们终于来讲DNMT2这个Dnmt家族成员中的奇葩了。
在1998年,Bestor实验室(Hum Mol Genet,1998)【19】和En Li实验室(Nucleic Acids Res,1998)【20】都克隆到了另一个Dnmt家族成员Dnmt2。Dnmt2从序列上看具有DNA甲基化的催化结构域(图1),并且Dnmt2在进化上高度保守,从酵母到人类均有保守的表达(线虫除外,线虫没有任何Dnmt基因)。但是En li实验室发现Dnmt2在细胞水平不具有DNA甲基化功能(Nucleic Acids Res,1998)【20】。随后Bestor实验室构建了Dnmt2敲除鼠,继续对其进行功能研究。
wt_a52362020016081117_5b0ee4.jpg
图1.DNMT家族成员的分子结构域(Nat Rev Genet,2018)【21】
当时Bestor实验室负责这个课题的博士生是Mary Grace Goll,当她拿到这个DNMT2敲除鼠后,发现小鼠好像活得很好;而且DNMT2的蛋白定位于细胞质而不是细胞核,同时也检测不到明显的DNA甲基化水平的变化……实在是郁闷。但是据说Mary是一个好学生,做事情非常严谨,实验技术也非常扎实,她也不相信这么重要一个基因怎么会就没有function呢?于是她非常认真地从小鼠各个方面的表型以及DNA甲基化层面(其研究延伸到了DNMT2敲除的果蝇,以及DNMT2敲除的拟南芥)去寻找DNMT2敲除的表型,一做就是7年wt_a72362020061081117_5cc6f5.jpg……直到2005年的时候,她终于打算放弃了,打算写一个充满了DNMT2阴性结果的博士论文后毕业走人,Bestor也同意了。然而在写论文的时候,她突发奇想了一下:“既然我已经证明了Dnmt2不能甲基化DNA,干脆我把RNA也做一下,顺便证明DNMT2也不能甲基化RNA吧,这样把DNMT2拍死算了,论文也完整一些……”于是她就真去做了一把实验,结果这一做把她吓着了,怎么Dnmt2敲除还真看到RNA的m5C变化了!?由于做了7年已经习惯了拿阴性结果,一下子看到阳性结果还不敢相信……于是她把手上各种能够用到的DNMT2敲除的细胞,组织,物种,都做了一次,发现这个结果是真的……于是她找到了Bestor说:“I finally figure out what DNMT2 can do……”在后面的5个月里,Mary进一步把DNMT2对RNA的甲基化功能定位到了tRNA-asp上38位的Cytosine(C38),并证明在小鼠、果蝇、拟南芥中的DNMT2都是这个保守的功能。另外还证明DNMT2对这个tRNA C38位点的甲基化还需要依赖于tRNA的特殊结构构象(这种tRNA构象的形成依赖于tRNA上其他丰富的修饰参与),因为纯化出来的DNMT2可以给来自DNMT2敲除动物/植物的tRNA-asp在C38加上一个m5C,但是不能给体外直接转录出的tRNA-asp(这种tRNA上面没有其他修饰)加上m5C。这些结果于2005年10月投到Science,2005年12月接收(Science,2006)【22】(图2)。至此,这个里程碑式的工作终于让科学界对DNMT2的功能有了一个靠谱的认识。(Mary Grace Goll目前在University of Geogia当PI,她似乎没有继续从事Dnmt2相关的工作。)
注:此部分故事由笔者根据当年在Bestors实验室的博士后Shau-Ping Lin口述转述。Shau-Ping Lin在剑桥大学Anne C.Ferguson-Smith实验室拿到PhD,现在中国台湾任PI。Anne C.Ferguson-Smith是Azim Surani的学生,研究imprinting gene的先驱之一(Igf2r,Igf2和H19几个最初发现的小鼠的imprinting gene均在1991年被报道)(Nature【23】,Cell【24】,Nature【25】,Nature【26】)。
wt_a42302020616081117_5e9e97.jpg
图2.DNMT2将tRNA(Asp,Gly,Val)C38位点的C催化为m5C(Nat Rev Genet,2018)【21】
DNMT2甲基化tRNA的功能发现之后,其他一直在相关领域活跃的科学家也恍然大悟,也迅速跟进,其中Albert Jeltsch实验室在2008年证明human DNMT2也具有催化tRNA-asp C38的类似功能,并且通过大量的DNMT2突变实验证明DNMT2对tRNA的甲基化所需要的结构域于其他Dnmt家族成员催化DNA甲基化用到的结构域的很像,却与其他RNA甲基化酶非常不同(RNA,2008)【27】。(这也进一步提示DNMT2是个奇葩的东西~)
另外,之前在Jaenisch实验室从事DNMT相关工作的博士后Frank lyko,也在这个领域迅速跟进并作出了重要贡献。(Frank Lyko在Jaenisch实验室曾在果蝇中检测DNA甲基化,发现其含量非常低(Nature,2000)【28】。如果给果蝇过表达DNMT1和DNMT3,果蝇DNA出现过量的甲基化,影响果蝇存活(Nat Genet,1999)【29】。(注:果蝇基因组中只有DNMT2这一个Dnmt家族成员)。Frank lyko在德国有了自己的实验室以后,在2009年建立了一个RNA m5C bisulfite sequencing的检测方法(Nucleic Acids Res,2009)【30】,这个方法大大促进了高通量检测tRNA上m5C的检测效率,并且能够定位m5C的位点。通过这个方法,Lyko实验室在2010年进一步通过对比DNMT2野生型与敲除型果蝇后,发现DNMT2还能对除了tRNA-asp之外的其他tRNA(tRNA-Glu,tRNA-Gly)的C38进行m5C的修饰,并且证明tRNA在DNMT2缺失进而丢失C38的m5C情况下,容易在stress情况下断裂,进而生成过量的tRNA fragment(目前学界正在建议将tRNA fragment改名为tsRNA(tRNA-dervided small RNA)(Gene Dev,2010)【31】。这个机理在小鼠中保守存在(Nat Struct Mol Cell Biol,2012)【32】。Dnmt2缺失导致tRNA断裂的增加以及tsRNA的堆积会对果蝇在应激情况下产生表型,导致果蝇生存力下降(Gene Dev,2010)【31】(图3);Dnmt2缺失在小鼠虽无明显表型(Nat Struct Mol Cell Biol,2012)【32】,但细致检查后发现对新生小鼠软骨骨化和造血有一定影响(EMBO J,2015)【31】。并且Lyko实验室还证明Dnmt2缺失导致的tRNA-C38甲基化丢失会导致tRNA对于其携带氨基酸的准确性降低(无法精确区分Asp和Glu)(EMBO J,2015)【33】。
wt_a82302020061681118_60a293.jpg
图3.tRNA缺失DNMT2介导的C38位m5C甲基化之后容易被切割产生tsRNA(Trends Mol Med,2016)【34】
值得一提的是,Frank Lyko实验室在2013年和Wolf Reik,Gregory Hannon两位大咖合作,在PNAS发了一篇论文,在果蝇、Schistosoma mansoni(曼氏裂体吸虫,一种寄生虫)(这两个物种的基因组中只有DNMT2这一个Dnmt家族成员),以及基因改造后只表达DNMT2的小鼠胚胎干细胞(敲除Dnmt1,Dnmt3a,Dnmt3b)这几个Dnmt2-only体系中,通过单碱基精度的whole-genome bisulfite sequencing对DNMT2在DNA甲基化方面的作用进行了几乎全面的否定(这包括对他自己当年博后期间发的文章(Nature,2000)【28】,以及Albert Jeltsch实验室的文章(EMBO J,2000)【35】进行了否定),认为过去检测到的非常低剂量的DNA甲基化也许都来自其他物种DNA的污染(PNAS,2013)【36】。Frank Lyko发表这篇文章是勇气可嘉的,这也推动了领域向正确的方向发展。
在DNMT2对tRNA修饰以及生物功能逐渐揭示的同时,另一个与其看似相去甚远的领域也在冉冉升起,并最终开始与DNMT2的相关研究开始汇合。这个领域就是我们要讲到的epigenetic inheritance(表观遗传信息的跨代遗传现象)。由于在受精卵时期和胚胎发育的PGC(Primordial germ cell,原始生殖细胞)时期,基因组会经历两次epigenetic reprogramming,清除大部分的DNA甲基化以及染色质上的修饰(Science,2010)【37】,所以过去学界一般认为上一代获得的表观遗传信息无法传递到下一代。然而近年来的研究越来越多的表明确实有一些上一代的获得性性状能够传递给下一代(精神紧张,饮食导致的代谢疾病等),这激发了科学家很大的兴趣,一部分学者认为有些DNA甲基化或者染色质上的修饰可以逃逸epigenetic reprogramming,而另一部分则认为也许携带这些获得性性状的分子信息的储存并不是依赖于DNA及其相关修饰(比如被RNA所携带)(Nat Rev Genet,2016)【38】。Minoo Rassoulzadegan实验室是在哺乳动物中研究精子RNA介导表观遗传现象的先驱,她们于2006年发现kit敲除鼠的杂合子小鼠会出现一种“白尾巴”的表型,同时杂合子雄鼠的睾丸和精子中会出现一堆异常表达的Kit mRNA片段,如果把这些奇怪的kit RNA片段注射到正常的受精卵里,会导致后代的小鼠(基因型为野生型)也出现类似于kit杂合子的“白尾巴”表型(Nature,2006)【39】,这提示RNA也许可以作为一种表观遗传信息载体介导后代的表型。在2013年,Lyko实验室和Minoo实验室合作,发表了一篇有趣的论文,他们报道说DNMT2的缺失可以阻断这种由精子RNA介导的非孟德尔遗传现象——如果同样把奇怪的kit RNA注射到DNMT2敲除的受精卵里,出生的后代中这种“白尾巴”表型就消失了(Plos Genet,2013)【40】。Lyko和Minoo观察到这个奇怪的现象后,试图从RNA甲基化的角度来解释,他们报道DNMT2能够在一定程度上影响kit mRNA某些C位点上的甲基化,但因为DNMT2对于mRNA的甲基化活性目前没有确切的证据,这个解释的可靠性尚有争议。
在Lyko和Minoo投稿这篇Plos Genet的时候(2012年10月),来自中科院动物所段恩奎和Qi Chen(现在UCR任PI)实验室的一项研究发现,小鼠成熟精子中含有大量的tsRNA(富集在30-40nt)(图4)(含量远高于miRNA和piRNA,这也是第一次在哺乳动物生理情况下发现大量的tsRNA的富集,随后段恩奎/Qi Chen团队还进一步和山东大学陈子江实验室以及云南灵长类中心的季维智实验室合作,发现tsRNA在包括猴子和人的各种脊椎动物血清中也大量保守存在,并在疾病状态下发生敏感变化(J Mol Cell Biol【41】),然而这些tsRNA的具体功能尚未知晓(Cell Res,2012)【42】(据说当时这篇文章在对tsRNA功能尚不清楚的情况下能得到快速发表,得力于Cell Research李党生和裴钢的大力支持。据说当时党生看了这个发现之后说:“赶紧投过来……”)。文章发表之后,Cell Research邀请Minoo对这个工作进行Highlight点评,文中推测精子中这些大量的tsRNA也许和RNA介导的epigenetic inheritance有关(Cell Res,2013)【43】。后来中科院科学家通过多方合作(周琪、段恩奎,翟琦巍和Qi Chen实验室),在一个通过高脂饮食诱导的小鼠跨代遗传模型中证实了这个猜测:通过给正常受精卵注射来自于高脂小鼠的精子RNA(总RNA或30-40nt区段的RNA),发现后代小鼠能够继承父代小鼠的获得性代谢紊乱,这证明小鼠精子中的tsRNA在介导父代获得性性状(代谢异常)的跨代遗传中具有重要作用;并且发现高脂饮食能够诱导精子RNA中30-40nt区段的RNA修饰(m5C,m2G升高)发生明显改变,提示RNA修饰也参与了跨代信息的传递(Science,2016)【44】。同时,马萨诸塞大学医学院的Oliver Rando实验室也与Craig C.Mello等实验室合作,也发表了一篇背靠背的Science文章报道在低蛋白饮食的小鼠模型中精子tsRNA成分也发生了变化,以及给受精卵注射tsRNA可以改变早期胚胎基因的表达(Science,2016)【45】。(延伸阅读:BioArt之前对此做过深度报道:【新增BioArt按】你遗传给后代的比你想象的要多——表观遗传的祖辈“原罪”)
wt_a62312020066081118_637426.jpg
图4.小鼠精子发生到成熟过程中小RNA的动态变化(Nat Rev Genet,2016)【38】
有意思的是,Lyko和Minoo的工作(PloS genet,2013)【40】以及中科院的合作工作(Science,2016)【44】都尝试了注射化学合成的不带修饰的小RNA,但是都发现不带有修饰的RNA无法诱导后代表现。这提示了小RNA上携带的RNA修饰对携带跨代遗传信息是非常重要的。随后两个团队分别在两篇各自的Nat Rev Genet综述中提到下一步研究精子RNA的修饰是理解精子跨代遗传的一个重要方向(Nat Rev Genet,2016)【38】,(Nat Rev Genet,2018)【21】。DNMT2可能通过tRNA修饰,以及对精子tsRNA biogenesis的调控,在epigenetic inheritance中起到关键作用。
2018年,中科院团队(段恩奎/张莹和周琪实验室)和Frank Lyko,Qi Chen实验室再度合作,将精子RNA/tsRNA跨代遗传方面的研究和Dnmt2功能进一步联系了起来。通过小鼠高脂肪模型,合作团队发现在高脂肪饮食下,野生型小鼠的精子RNA(总RNA,或者30-40nt区段的RNA)能够将父代的获得性代谢表型传递给子代;但是同样在高脂肪饮食下,Dnmt2敲除鼠的精子RNA则不能将父代的代谢表型传递给子代。这说明在高脂饮食情况下,Dnmt2对塑造精子RNA所携带的父代获得性状的“指纹编码(coding signature)”具有重要的作用(Nat Cell Biol,2018)【46】。而这种精子RNA的“指纹编码”似乎是由精子RNA序列和RNA修饰共同组成(图5),因为Dnmt2介导的RNA修饰能够明显地改变精子tsRNA的结构和功能;并且Dnmt2的缺失也直接导致精子tsRNA的m5C修饰以及表达谱发生变化,以及精子中rsRNA(rRNA-derived small RNA)的表达变化(精子中的rsRNA是由中科院张永莲实验室报道发现(J Mol Cell Biol,2017)【47】)(Nat Cell Biol,2018)【46】。这项研究从Dnmt2和RNA修饰的角度进一步强调了精子RNA携带父代获得性信息的复杂调控。
wt_a82302020061681118_674666.jpg
图5.DNMT2对饮食诱导形成的精子RNA“指纹编码”至关重要(Nat Cell Biol,2018)【46】
最后加一些花絮:
Timothy H.Bestor是一个非常严谨的科学家,对于很多研究的结论是比较保守的,比如对当年TET酶发现之前关于DNA主动去甲基化的工作持谨慎的怀疑态度,从他们的综述中可见(Cell,2008)【48】;并且Bestor似乎也不太喜欢关于epigenetic inheritance的研究,特别是关于DNA甲基化作为跨代遗传信息的观点,见他的另一篇评述(PNAS,2015)【49】。
关于DNMT2的名字:由于现在的主要证据表明DNMT2的主要底物是tRNA,而不是DNA,于是HUGO Gene Nomenclature Committee打算把他从Dnmt家族中除名了,名字从DNMT2(DNA(cytosine-5)-methyltransferase 2)改成TRDMT1(tRNA aspartic acid methyltransferase 1)(Nucleic Acids Res,2015)【50】。但是Frank Lyko,Albert Jeltsch等相关研究实验室对这个决定不同意,建议应该保留DNMT2这个名字,因为他们认为DNMT2的诸多特性决定了它是一个非常与众不同的的RNA甲基化酶,特别是DNMT2执行催化方式的分子机理和其他Dnmt家族成员非常类似,而和其他的RNA甲基化酶非常不同(Nat Rev Gent,2018)【21】。另外,(笔者认为)由于DNMT2的底物也不止tRNA-asp一个,所以起名叫tRNA aspartic acid methyltransferase也显得有点太过局限。
最近,另一个精通RNA修饰相关研究的德国实验室Mark Helm(Frank Lyko和Albert Jeltsch的好友)通过一系列巧妙的实验证明,如果在保证tRNA的分子构象基础上,把DNMT2修饰位点(C38)及其附近的序列改为DNA的话,DNMT2就能对这些插入tRNA构象中的DNA进行甲基化,而这一功能是其他RNA methyltransferase无法实现的(RNA Biol,2017)【51】。这个证据进一步提示也许在某些特殊情况下(特殊构象等)DNMT2也是能够对DNA进行甲基化的。事实上,根据DNMT2在进化上的高度保守性,目前的另一种观点甚至认为目前能够甲基化DNA的Dnmt家族成员,有可能是从DNMT2-like RNA methyltransferase演化来的,而不是从原核生物的DNA甲基化酶变来的;因为和后者相比,Dnmt家族在结构和催化特性上具有更加巨大的差别。
编后记:中国科学院动物研究所段恩奎/张莹研究组和周琪研究组,与美国University of Nevada,Reno的Qi Chen实验室以及德国German Cancer Research Center的Frank Lyko实验室合作,揭示了RNA甲基化转移酶Dnmt2在精子RNA介导的获得性代谢疾病跨代遗传中的重要作用。该研究成果以Dnmt2 mediates intergenerational transmission of paternally acquired metabolic disorders through sperm small non-coding RNAs为题,于2018年4月25日在Nature Cell Biology杂志在线发表。
wt_a22322000616081118_68fc0d.jpg
参考文献
1.Harbers,K.,Schnieke,A.,Stuhlmann,H.,Jahner,D.&Jaenisch,R.DNA methylation and gene expression:endogenous retroviral genome becomes infectious after molecular cloning.Proceedings of the National Academy of Sciences of the United States of America 78,7609-7613(1981).
2.Bestor,T.H.&Ingram,V.M.Two DNA methyltransferases from murine erythroleukemia cells:purification,sequence specificity,and mode of interaction with DNA.Proceedings of the National Academy of Sciences of the United States of America 80,5559-5563(1983).
3.Li,E.,Bestor,T.H.&Jaenisch,R.Targeted mutation of the DNA methyltransferase gene results in embryonic lethality.Cell 69,915-926(1992).
4.Walsh,C.P.,Chaillet,J.R.&Bestor,T.H.Transcription of IAP endogenous retroviruses is constrained by cytosine methylation.Nature genetics 20,116-117(1998).
5.Li,E.,Beard,C.&Jaenisch,R.Role for DNA methylation in genomic imprinting.Nature 366,362-365(1993).
6.Surani,M.A.,Barton,S.C.&Norris,M.L.Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis.Nature 308,548-550(1984).
7.McGrath,J.&Solter,D.Completion of mouse embryogenesis requires both the maternal and paternal genomes.Cell 37,179-183(1984).
8.Reik,W.,Collick,A.,Norris,M.L.,Barton,S.C.&Surani,M.A.Genomic imprinting determines methylation of parental alleles in transgenic mice.Nature 328,248-251(1987).
9.Inoue,A.,Jiang,L.,Lu,F.,Suzuki,T.&Zhang,Y.Maternal H3K27me3 controls DNA methylation-independent imprinting.Nature 547,419-424(2017).
10.Beard,C.,Li,E.&Jaenisch,R.Loss of methylation activates Xist in somatic but not in embryonic cells.Genes&development 9,2325-2334(1995).
11.Panning,B.&Jaenisch,R.DNA hypomethylation can activate Xist expression and silence X-linked genes.Genes&development 10,1991-2002(1996).
12.Okano,M.,Bell,D.W.,Haber,D.A.&Li,E.DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development.Cell 99,247-257(1999).
13.Bourc'his,D.,Xu,G.L.,Lin,C.S.,Bollman,B.&Bestor,T.H.Dnmt3L and the establishment of maternal genomic imprints.Science 294,2536-2539(2001).
14.Bourc'his,D.&Bestor,T.H.Meiotic catastrophe and retrotransposon reactivation in male germ cells lacking Dnmt3L.Nature 431,96-99(2004).
15.Jia,D.,Jurkowska,R.Z.,Zhang,X.,Jeltsch,A.&Cheng,X.Structure of Dnmt3a bound to Dnmt3L suggests a model for de novo DNA methylation.Nature 449,248-251(2007).
16.Zhang,Z.M.et al.Structural basis for DNMT3A-mediated de novo DNA methylation.Nature 554,387-391(2018).
17.Ooi,S.K.et al.DNMT3L connects unmethylated lysine 4 of histone H3 to de novo methylation of DNA.Nature 448,714-717(2007).
18.Barau,J.et al.The DNA methyltransferase DNMT3C protects male germ cells from transposon activity.Science 354,909-912(2016).
19.Yoder,J.A.&Bestor,T.H.A candidate mammalian DNA methyltransferase related to pmt1p of fission yeast.Human molecular genetics 7,279-284(1998).
20.Okano,M.,Xie,S.&Li,E.Dnmt2 is not required for de novo and maintenance methylation of viral DNA in embryonic stem cells.Nucleic acids research 26,2536-2540(1998).
21.Lyko,F.The DNA methyltransferase family:a versatile toolkit for epigenetic regulation.Nature reviews.Genetics 19,81-92(2018).
22.Goll,M.G.et al.Methylation of tRNAAsp by the DNA methyltransferase homolog Dnmt2.Science 311,395-398(2006).
23.Barlow,D.P.,Stoger,R.,Herrmann,B.G.,Saito,K.&Schweifer,N.The mouse insulin-like growth factor type-2 receptor is imprinted and closely linked to the Tme locus.Nature 349,84-87(1991).
24.DeChiara,T.M.,Robertson,E.J.&Efstratiadis,A.Parental imprinting of the mouse insulin-like growth factor II gene.Cell 64,849-859(1991).
25.Ferguson-Smith,A.C.,Cattanach,B.M.,Barton,S.C.,Beechey,C.V.&Surani,M.A.Embryological and molecular investigations of parental imprinting on mouse chromosome 7.Nature 351,667-670(1991).
26.Bartolomei,M.S.,Zemel,S.&Tilghman,S.M.Parental imprinting of the mouse H19 gene.Nature 351,153-155(1991).
27.Jurkowski,T.P.et al.Human DNMT2 methylates tRNA(Asp)molecules using a DNA methyltransferase-like catalytic mechanism.Rna 14,1663-1670(2008).
28.Lyko,F.,Ramsahoye,B.H.&Jaenisch,R.DNA methylation in Drosophila melanogaster.Nature 408,538-540(2000).
29.Lyko,F.et al.Mammalian(cytosine-5)methyltransferases cause genomic DNA methylation and lethality in Drosophila.Nature genetics 23,363-366(1999).
30.Schaefer,M.,Pollex,T.,Hanna,K.&Lyko,F.RNA cytosine methylation analysis by bisulfite sequencing.Nucleic acids research 37,e12(2009).
31.Schaefer,M.et al.RNA methylation by Dnmt2 protects transfer RNAs against stress-induced cleavage.Genes&development 24,1590-1595(2010).
32.Tuorto,F.et al.RNA cytosine methylation by Dnmt2 and NSun2 promotes tRNA stability and protein synthesis.Nature structural&molecular biology 19,900-905(2012).
33.Tuorto,F.et al.The tRNA methyltransferase Dnmt2 is required for accurate polypeptide synthesis during haematopoiesis.The EMBO journal 34,2350-2362(2015).
34.Zhang,X.,Cozen,A.E.,Liu,Y.,Chen,Q.&Lowe,T.M.Small RNA Modifications:Integral to Function and Disease.Trends in molecular medicine 22,1025-1034(2016).
35.Gowher,H.,Leismann,O.&Jeltsch,A.DNA of Drosophila melanogaster contains 5-methylcytosine.The EMBO journal 19,6918-6923(2000).
36.Raddatz,G.et al.Dnmt2-dependent methylomes lack defined DNA methylation patterns.Proceedings of the National Academy of Sciences of the United States of America 110,8627-8631(2013).
37.Feng,S.,Jacobsen,S.E.&Reik,W.Epigenetic reprogramming in plant and animal development.Science 330,622-627(2010).
38.Chen,Q.,Yan,W.&Duan,E.Epigenetic inheritance of acquired traits through sperm RNAs and sperm RNA modifications.Nature reviews.Genetics 17,733-743(2016).
39.Rassoulzadegan,M.et al.RNA-mediated non-mendelian inheritance of an epigenetic change in the mouse.Nature 441,469-474(2006).
40.Kiani,J.et al.RNA-mediated epigenetic heredity requires the cytosine methyltransferase Dnmt2.PLoS genetics 9,e1003498(2013).
41.Zhang,Y.et al.Identification and characterization of an ancient class of small RNAs enriched in serum associating with active infection.Journal of molecular cell biology 6,172-174(2014).
42.Peng,H.et al.A novel class of tRNA-derived small RNAs extremely enriched in mature mouse sperm.Cell research 22,1609-1612(2012).
43.Kiani,J.&Rassoulzadegan,M.A load of small RNAs in the sperm-how many bits of hereditary information?Cell research 23,18-19(2013).
44.Chen,Q.et al.Sperm tsRNAs contribute to intergenerational inheritance of an acquired metabolic disorder.Science 351,397-400(2016).
45.Sharma,U.et al.Biogenesis and function of tRNA fragments during sperm maturation and fertilization in mammals.Science 351,391-396(2016).
46.Zhang,Y.et al.Dnmt2 mediates intergenerational transmission of paternally acquired metabolic disorders through sperm small non-coding RNAs.Nature cell biology(2018).
47.Chu,C.et al.A sequence of 28S rRNA-derived small RNAs is enriched in mature sperm and various somatic tissues and possibly associates with inflammation.Journal of molecular cell biology 9,256-259(2017).
48.Ooi,S.K.&Bestor,T.H.The colorful history of active DNA demethylation.Cell 133,1145-1148(2008).
49.Bestor,T.H.,Edwards,J.R.&Boulard,M.Notes on the role of dynamic DNA methylation in mammalian development.Proceedings of the National Academy of Sciences of the United States of America 112,6796-6799(2015).
50.Gray,K.A.,Yates,B.,Seal,R.L.,Wright,M.W.&Bruford,E.A.Genenames.org:the HGNC resources in 2015.Nucleic acids research 43,D1079-1085(2015).
51.Kaiser,S.et al.The RNA methyltransferase Dnmt2 methylates DNA in the structural context of a tRNA.RNA biology 14,1241-1251(2017).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652488178&idx=6&sn=ad0ed18373d8a3171a831705e5828cba&chksm=84e25246b395db500cde0469945bdac597c4ec22b478d2f789eba87ba6b105a9c3e6c0933ada#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Cell:利用DNA甲基化图谱重构古人类解剖学特点

【分享】APELA基因在子痫前期中的DNA甲基化

肠癌血浆DNA甲基化检测——数字PCR技术

当DNA甲基化遇上RNA甲基化:果实成熟的表观遗传调控
Nat Plants:植物如何防晒?抑制DNA甲基化
研究发现植物DNA主动去甲基化新机制

当DNA甲基化遇上RNA甲基化:果实成熟的表观遗传调控 | Genome Biology

新突破! 二维实验系统成功应用于四维材料研究
更好的期刊,更好的科学——中国科技峰会·世界科技期刊论坛专家观点荟萃



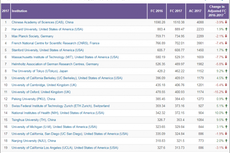
中科院位列2018自然指数榜单全球十大科研机构首位