科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-21
来源:BioArt
责编 | 酶美
ATP不仅是细胞中主要的能源物质,也是许多生理过程中重要的信号分子。由于ATP分子的体积和电荷,其通常会通过ATP释放通道来穿过脂质双分子层,目前已知的ATP释放通道主要有:连接蛋白 (connexin) 、泛连接蛋白 (pannexin 1)、钙稳态调节蛋白1(CALHM1)、体积调节阴离子通道 (VRACs) 以及最大阴离子通道 (MACs) 【1】。
CALHM1 (Calcium homeostasis modulator 1) 是一种电压门控的ATP释放通道,可以介导II型味觉细胞向味觉神经的嘌呤能神经传递,从而使人感知甜味、苦味和鲜味,同时其也是受电压和细胞外Ca2+浓度变构调节的非选择性离子通道,与一些神经系统疾病相关。近期,CALHM家族多个成员的结构被解析出来,2019年11月27日人源CALHM2结构在Nature杂志被报道,显示了一个11聚体的结构【2】;紧接着,2020年1月27日,Nature Structural & Molecular Biology杂志报道了人源CALHM2和鸡源CALHM1的结构,分别显示了11聚体和八聚体的结构【3】。2020年5月6日,eLife杂志报道了人源CALHM2, CALHM4, CALHM6的结构【4】,其中CALHM4显示了10/11聚体,CALHM6显示了10聚体的结构。2020年6月18日,Protein Science杂志报道了线虫CALHM1的结构,显示了10聚体【5】。这些结构分析表明了CALHM家族成员可以形成不同的多聚体结构。但是所有这些结构都缺乏关键的调控元件N端的结构信息。
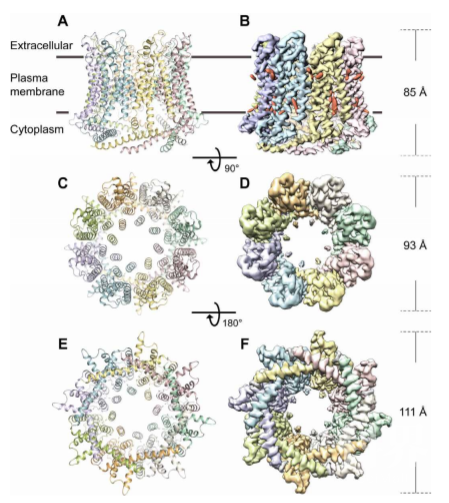
2020年7月17日,南开大学沈月全/杨雪团队在Science Advances杂志上发表了题为Cryo-EM structure of the calcium homeostasis modulator 1 channel的文章,该研究运用冷冻电镜的方法解析了斑马鱼源CALHM1通道在无Ca2+条件下的三维结构,整体分辨率可达3.1 Å,并且首次解析出N端小螺旋的结构,为进一步了解CALHM1的组装及其门控机制提供了新见解。

在这项研究中,该团队首先解析了斑马鱼源CALHM1在无钙离子条件下的激活状态结构,显示为八聚体的结构,有着较大的中间孔径约为20Å。整体结构与可形成十二聚体半通道和间隙连接的CALHM2有着显著的不同。其N端小螺旋折回孔中,与跨膜螺旋1反向平行形成相互作用,可能对CALHM1通道的门控有调节作用,但不太可能充当唯一的通道门控元件。结构分析表明,二聚体交界处的连接区域可能对寡聚体的组装有重要作用。同时,通过对孔道的表面静电势进行分析,发现孔内存在正电位环带,可能对离子的通透起到调控作用。本文报道的结构信息为进一步理解CLAHM通道的工作机制提供了新的见解。
据悉,该工作和浙江大学医学院张兴教授合作完成。南开大学药物化学生物学国家重点实验室的沈月全教授和杨雪副研究员为本文的共同通讯作者,南开大学药学院硕士生任悦为本文的第一作者。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652492492&idx=7&sn=79d9763a63606a96ed8f10d91ca17584&chksm=84e24178b395c86e49a30b3a338f2546bc9d79e43b04ccf5176fd7a8041ce5bdb12d279165f0#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
一个小小的细胞就有多达4200万个蛋白质分子

小鼠干细胞可在体外形成“类胚胎”结构
肿瘤细胞“抱团”促进转移的结构与分子机制

人工细胞与生物细胞首次实现成功融合与协作

人体细胞内存在“铁路”系统,能自动优化结构
亚细胞结构
大脑中发现“焦虑细胞”,为治疗焦虑症提供新方向
光介导ATP合成
FTIR光谱检测细胞ATP依赖型染色质重塑诱导Z-DNA构象
失去细胞核的细胞在3D环境中举步维艰