科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-21
来源:BioArt
撰文 | Leon
责编 | 雪月
核糖体是多肽合成的场所,科学家们常将其作为模型研究RNA结构和RNA-蛋白相互作用。核糖体也是许多小分子药物如抗生素的作用靶点。已有的核糖体晶体结构的分辨率不高(约3 Å),阻碍了相关药物的研发进展。随着技术的进步,高分辨率冷冻电镜正在挑战X射线晶体学在结构生物学的传统地位(详情请见BioArt报道:Cryo-EM 实现 1.25Å 分辨率,可视化单个原子以及化学修饰 | 被 Nature 翻牌的 bioRxiv :cryo-EM 分辨率发展到原子级别 )。
2020年6月26日,加州大学伯克利分校的Jamie Cate课题组在bioRxiv上传了题为Structure of the Bacterial Ribosome at 2 Å Resolution的论文,用冷冻电镜(cryo-EM)解析了大肠杆菌70S核糖体的结构,整体分辨率达到2 Å,局部分辨率可至1.8 Å。高分辨率的结构信息让研究者可以精确地描述核糖体与RNA之间、核糖体亚基之间以及核糖体与抗生素巴龙霉素之间的相互作用。此外,实验人员鉴定出了所有RNA和蛋白上的化学修饰,包括未被报道过的两种核糖体蛋白骨架上的翻译后修饰。
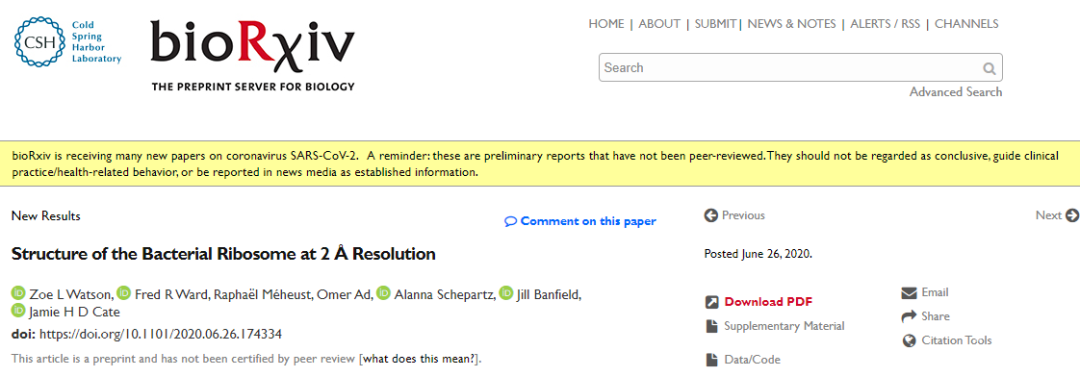
在核糖体蛋白uL16的82位甲硫氨酸和83位甘氨酸之间,研究者发现了硫代酰胺(thioamide)修饰。这是迄今为止第二次在蛋白里发现这种化学修饰【1】。硫羰基与典型的肽羰基相比,键长仅差了约0.4 Å而几何结构不变,这在低分辨率的结构模型中是很难被识别出来的。而在<2Å的分辨率下,电势差更为明显,从而可以被分辨出来(图1)。结合质谱(LC-MS/MS)数据,实验者确认了这种修饰的存在。然而,这种修饰的生理功能以及形成的分子机制仍然未知。
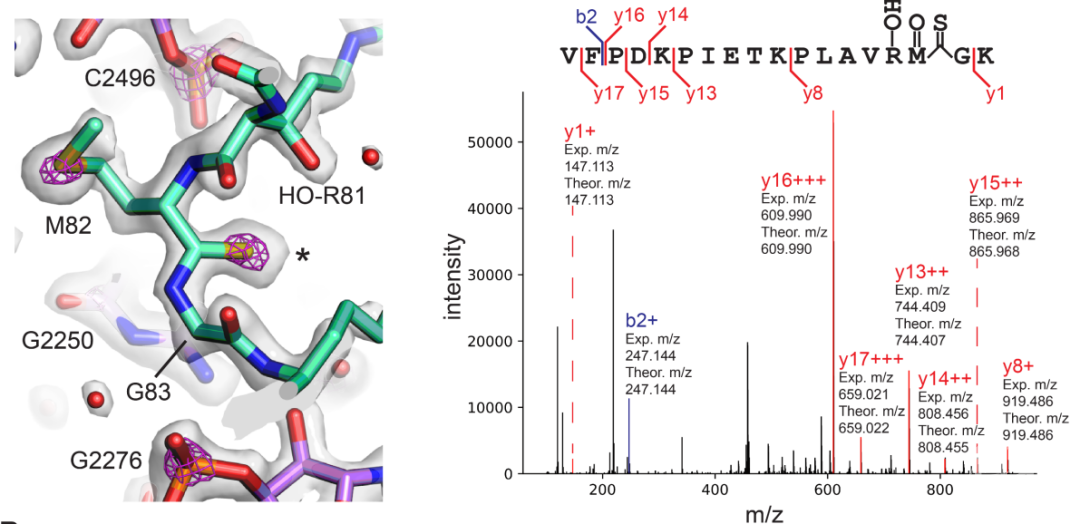
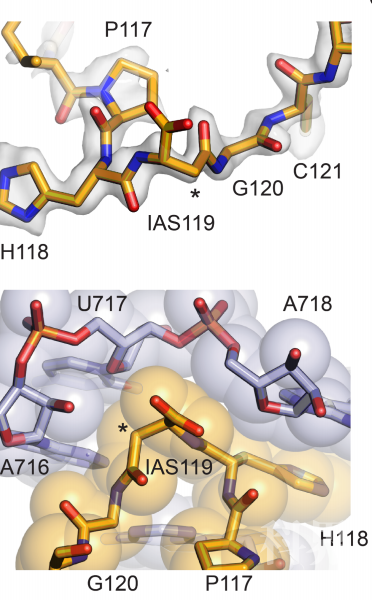
除了多肽骨架上的硫代酰胺修饰,研究人员还在核糖体的30S亚基上发现了核糖体蛋白上唯一的异肽键(isopeptide bond),即位于uS11核糖体蛋白第119位的异天冬氨酸(isoAsp)(图2)。isoAsp常被认为是蛋白质损伤的标志,其生物学意义尚不明确【2】。
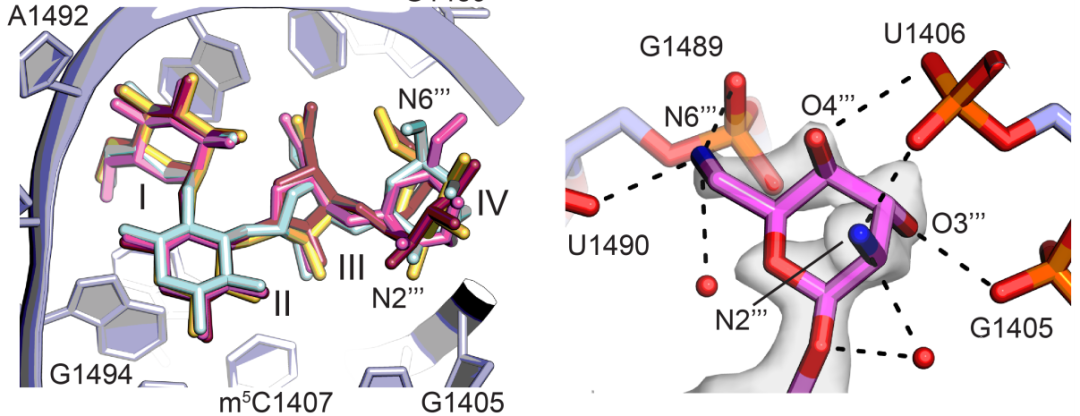
除了蛋白上的化学修饰,高分辨率的结构信息使得实验者可以鉴定出多种rRNA上的修饰,包括16S rRNA上的m7G527和m62A1519。这些化学修饰与链霉素和新霉素的抗性直接相关【3,4】。最后,实验人员分析了巴龙霉素与核糖体30S亚基之间的相互作用(图3)。
总而言之,这些化学修饰的发现,进一步加深了我们对核糖体结构与功能的了解。高分辨率下,抗生素的结合模式、蛋白质-RNA相互作用和溶剂分子的位置都一目了然。这项研究也将促进冷冻电镜数据处理和分析工具的进一步发展。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652492492&idx=8&sn=ef2a1696de19610d40599e21ba6062e7&chksm=84e24178b395c86eaebd06b46ee78910638a46d36d25e932c8ff3a1504e210889c256699fd18#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Nature:冷冻电镜发展到原子级别分辨率水平
中国科大成功解析人类疱疹病毒6B型近原子分辨率冷冻电镜结构
核糖体RNA
Nature :隋森芳组报道藻胆体2.8 Å分辨率的冷冻电镜三维结构
科学家解析CV-A10结构并筛选得到人肠道病毒广谱抑制剂
中国科大成功解析人类疱疹病毒6B型近原子分辨率冷冻电镜结构
中美联手借冷冻电镜开启解码之路
人源分泌型免疫球蛋白A复合体及其与肺炎链球菌黏附素的高分辨率冷冻电镜结构

核糖体碰撞与细胞命运

每日一词 | 高分五号 GF-5