科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-22
来源:Bio生物世界
N6甲基腺嘌呤(m6A)是真核生物mRNA上常见的修饰类型,受“书写”蛋白(METTL3/METTL14复合体),“擦除”蛋白(FTO和ALKBH5)及“阅读”蛋白(YTH家族蛋白和HNRNP等)的调控。
近年来,m6A被证明在多种生命过程中发挥重要作用,包括动物生长发育,果蝇性别决定,癌症发生发展,免疫反应以及胚胎发育等等。许多研究表明,m6A与肝细胞癌(HCC)密切相关,这也为研究肝细胞癌的分子发病机制提供了新的视角。
在所有恶性肿瘤中,肝癌的发病率在全球排名第六,死亡率在全球排名第四。根据全球疾病癌症负担合作组织研究统计,肝癌是2017年男女绝对寿命损失的第二大主要原因。肝细胞癌(HCC)是肝癌的最主要病理类型,尽管肝细胞癌的诊断和治疗已大大改善,但由于对肝细胞癌复杂的分子发病机制了解不足,很难预防其频繁复发或转移。因此,进一步阐明肝癌恶性生物学机制以开发更有效的治疗策略就显得非常重要。
近日,浙江大学医学院第一附属医院郑树森院士团队在Molecular Cancer 杂志(IF=15.302)发表了题为:ALKBH5 suppresses malignancy of hepatocellular carcinoma via m6A-guided epigenetic inhibition of LYPD1 的研究论文。
该研究表明,ALKBH5具有抑癌作用,它通过m6A依赖性方式在肝细胞癌细胞中减弱LYPD1的表达。这些发现丰富了对m6A调控的恶性肿瘤得认知,并为肝细胞癌得潜在生物标志物和治疗靶标提供了新见解。
该研究证实,ALKBH5在肝细胞癌中表达下调,而ALKBH5表达降低是肝细胞癌患者生存率降低的独立预后因素。在功能上,ALKBH5在体外和体内均会抑制肝细胞癌细胞的增殖和侵袭能力。
从机制上讲,ALKBH5介导的m6A去甲基化导致LYPD1的转录后抑制,而后者可以被m6A效应物IGF2BP1识别并稳定。此外,该研究还发现与ALKBH5相反,LYPD1诱导了肿瘤的致癌行为,因此,ALKBH5/LYPD1信号轴的失调促进了肝细胞癌的发展。
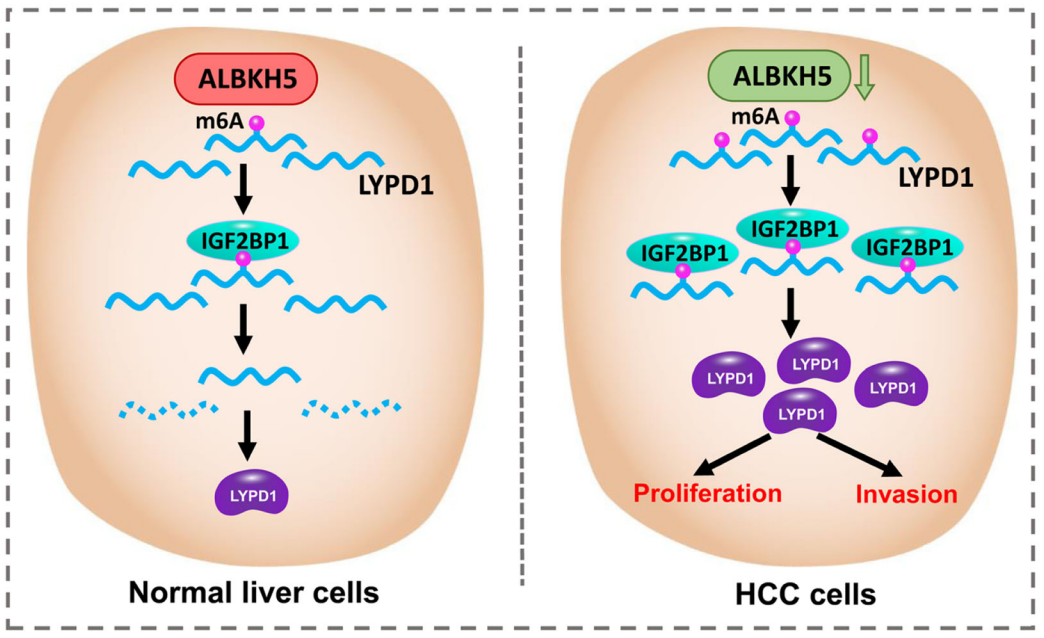
总之,这项工作揭示了ALKBH5在肝细胞癌发展中的抑癌特性。ALKBH5的下调激活了m6A机制,从而促进了LYPD1的表观遗传激活,而后者被IGF2BP1识别并稳定下来。
这些发现突出了m6A脱甲基化酶的重要价值,丰富了m6A转录组修饰在癌症研究中的理解,为进一步为开发有效的肝细胞癌预测因子和治疗策略提供了新的见解。
来源:ibioworld Bio生物世界
原文链接:https://mp.weixin.qq.com/s?__biz=MzU1MzMxMzcyMg==&mid=2247506951&idx=6&sn=2f79dbb9c4a711239dfef77a23205579&chksm=fbf628d2cc81a1c41720ff76170359e62df42af26f8eeacdccd941b6d03678caeded9abde4e7#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

科学家发表m6A长篇综述

发现ALKBH5在急性髓细胞性白血病的关键作用
澳大利亚icon医疗集团访问中国抗癌协会秘书处


第十四届海峡两岸肿瘤学术会议在台北成功召开




转录因子ZFP217调控m6A的新机制
伊成器/樊嘉合作组绘制人与小鼠m6A和m6Am甲基化图谱

m6A修饰调控体细胞重编程机理研究获进展

Nature热点 | m6A修饰促进蛋白相分离
中国抗癌协会王瑛秘书长出席河北省肿瘤防治宣传周启动仪式



中国抗癌协会整合肿瘤学分会成立大会在西安召开


