科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-05
来源:BioArt
撰文 | 飞绵
近年来,肿瘤免疫治疗颠覆了传统的以手术放化疗为主的肿瘤治疗方法【1】。针对PD-1和PD-L1设计的免疫检查点抑制剂(anti-PD-L1/PD-1)在多种肿瘤疾病中均表现出良好的疗效。其中包括黑色素瘤,小细胞肺癌和肾癌等。甚至一些接受多次标准治疗失败后的肿瘤患者在使用anti-PD-L1/PD-1治疗后都可以得到持续的缓解。但遗憾的是,在上述类型的肿瘤患者中,仅仅有10-30%的人群对anti-PD-L1/PD-1治疗敏感【2】。更有一些类型的肿瘤如前列腺癌,极少有对anti-PD-L1/PD-1治疗敏感的个体【3】。众所周知,肿瘤表面的PD-L1能够抑制T细胞的激活和及其杀伤功能【4, 5】,理论上讲anti-PD-L1/PD-1治疗对大部分肿瘤患者均会有明显的疗效。但是目前已有的研究结果却不支持这种推测,anti-PD-L1/PD-1治疗在不同患者以及不同肿瘤类型之间地疗效差异显著,其中的机制尚不明确。
2019年4月4日,来自加州大学旧金山分校的Robert Blelloch等研究人员在 Cell 上发表题目为Suppression of Exosomal PD-L Induces Systemic Anti-tumor Immunity and Memory的文章,从外泌体的角度很好地解释了部分肿瘤患者接受anti-PD-L1/PD-1治疗失败的机制。

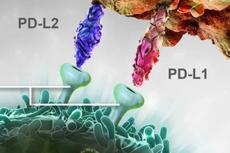
在文中作者提出了4个观点(图1):1. 抑制肿瘤细胞产生外泌体PD-L1(部分肿瘤细胞外泌体中检测到PD-L1)能够消除其对抗肿瘤免疫反应的抑制,从而延长小鼠的存活时间;2. 外泌体PD-L1能够抑制淋巴器官中T细胞的活性;3. 抑制肿瘤细胞产生外泌体PD-L1能够诱导小鼠形成对该肿瘤细胞的免疫记忆;4. PD-L1抑制剂对外泌体中的PD-L1似乎没有明显的抑制效果。
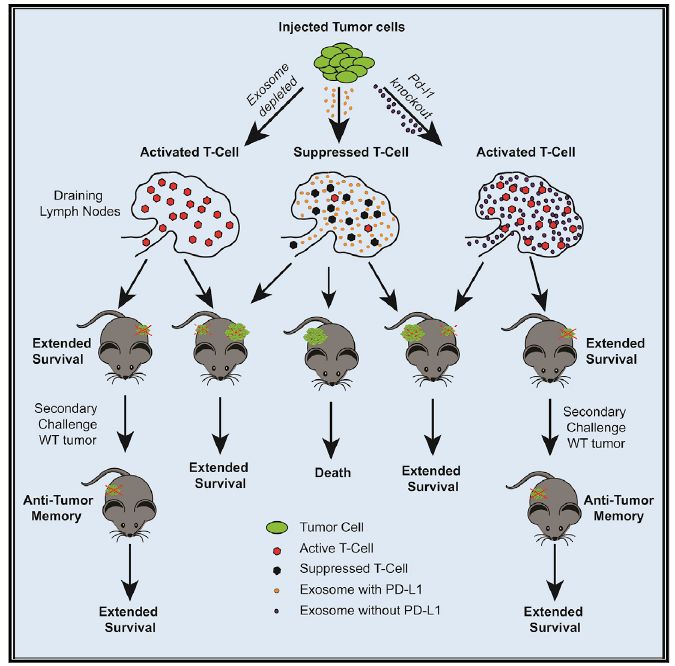
图1:全文图解摘要:PD-L1外泌体抑制全身的肿瘤免疫应答反应,当敲除外泌体形成和PD-L1表达相关基因后能够促进淋巴器官中的T细胞激活,并且形成针对该肿瘤抗原的免疫记忆。
首先,由于前列腺癌和黑色素瘤对anti-PD-L1/PD-1治疗的响应差别很大,因此作者研究了PC3(前列腺癌细胞系)和SK-MEL-28(黑色素瘤细胞株)这两株细胞系中PD-L1 mRNA和PD-L1蛋白含量之间的差异。结果出乎意料,PC3细胞中PD-L1 mRNA的含量是SK-MEL-28细胞中的15倍左右,而两株细胞中PD-L1蛋白的浓度却相差无几。进一步研究表明,基因转录后的翻译过程,溶酶体和蛋白酶对PD-L1蛋白的降解在这两种细胞中并无显著差异。造成上述mRNA水平和相应蛋白含量不匹配的主要原因是PC3细胞通过外泌体将表达的PD-L1分泌到细胞外,而SK-MEL-28细胞产生的外泌体不含有PD-L1。同时作者还发现2个在外泌体产生以及PD-L1分泌过程中非常重要的基因Rab27a和nSMase2。
在证明了PC3细胞外泌体中PD-L1的存在后,下一步作者研究了该外泌体中的PD-L1是否能够抑制T细胞的功能。首先作者使用Raji细胞和Jurkat T 细胞作为模型,通过检测共孵育后上清中IL-2的含量来反应T细胞的激活情况。结果表明来源于PC3细胞包含有PD-L1的外泌体能够抑制Jurkat T细胞的激活,而敲除PD-L1基因的PC3细胞来源的外泌体却没有上述的抑制效果。随后作者使用基于TRAMP-C2细胞的前列腺癌小鼠模型进行研究(该模型小鼠对anti-PD-L1/PD-1治疗无响应)【6】。通过CRISPR/Cas9的技术,分别敲除了TRAMP-C2 细胞中的Rab27a、Pd-l1和nSMase2基因,需要强调的是,敲除这三种基因均不影响肿瘤细胞的生长和分裂,其中敲除Rab27a基因能够抑制外泌体的产生,但是不干扰肿瘤细胞表面的PD-L1表达,敲除Pd-l1和nSMase2基因均能够抑制细胞中PD-L1的表达。在使用上述基因编辑后的肿瘤细胞接种到小鼠体内进行成瘤实验发现,抑制外泌体产生或者是PD-L1的表达均能够显著提升荷瘤小鼠的生存时间,部分小鼠在接种基因敲除的肿瘤细胞后90天依然存活。在进一步研究后发现,免疫缺陷小鼠接种上述基因敲除的TRAMP-C2细胞后其生存时间与接种野生型TRAMP-C2细胞的小鼠无差异,从而证明通过抑制肿瘤细胞外泌体产生或者是PD-L1表达的手段提高小鼠的生存时间要基于小鼠具备正常的免疫应答功能。
基于以上结果,作者随后研究了分别接种野生型的或者是经过PD-L1和外泌体产生相关基因敲除的TRAMP-C2后小鼠体内的免疫应答反应,结果表明,载有PD-L1的外泌体在淋巴器官中抑制了T细胞的功能,从而促进肿瘤的生长。在对接种经过基因修饰的TRAMP-C2细胞后90天依然存活的小鼠进行二次接种,二次接种所使用的是未经基因修饰的野生型TRAMP-C2细胞,该小鼠表现出了对TRAMP-C2细胞的免疫记忆效果,虽然该细胞表达PD-L1,和产生外泌体的功能完全正常。同时作者发现,前述的外泌体PD-L1抑制体内肿瘤免疫反应的作用不仅仅局限于TRAMP-C2肿瘤小鼠模型,使用MC38肿瘤模型小鼠进行研究也得到了相似的结果。
最后,作者使用野生型TRAMP-C2细胞和基因敲除的TRAMP-C2细胞共同接种到小鼠不同部位,观察肿瘤生长的速度,发现与基因敲除的TRAMP-C2细胞共同接种后,野生型的TRAMP-C2肿瘤生长速度明显降低。随后作者还使用包含有PD-L1的外泌体过继性输入到荷瘤小鼠体内,观察到了PD-L1外泌体对肿瘤免疫的抑制效果。说明了肿瘤细胞产生的载有PD-L1的外泌体通过血液流动分布在全身各处,发挥其抑制抗肿瘤免疫的功能。
综上所述,作者发现来源于肿瘤细胞外泌体中的PD-L1能够抑制机体的抗肿瘤免疫应答,在通过基因编辑的方法抑制肿瘤细胞产生外泌体或者PD-L1表达后,荷瘤小鼠全身的抗肿瘤免疫反应明显被激活,并且形成了对该类型肿瘤的免疫记忆,再次接种的肿瘤细胞在短时间内即被清除。该研究很好地解释了部分肿瘤患者接受anti-PD-L1/PD-1治疗失败的机制,并且为今后与anti-PD-L1/PD-1治疗相关的基础与临床研究提出了新的研究方向和思路。
原文链接:
https://doi.org/10.1016/j.cell.2019.02.016
制版人:珂
参考文献
1. Chen, D.S., and Mellman, I. (2017). Elements of cancer immunity and the cancer-immune set point. Nature 541, 321–330.
2. Page, D.B., Postow, M.A., Callahan, M.K., Allison, J.P., and Wolchok, J.D. (2014). Immune modulation in cancer with antibodies. Annu. Rev. Med. 65, 185–202.
3. Goswami, S., Aparicio, A., and Subudhi, S.K. (2016). Immune checkpoint therapies in prostate cancer. Cancer J. 22, 117–120.
4. Topalian, S.L., Drake, C.G., and Pardoll, D.M. (2015). Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell 27, 450–461.
5. Hui, E., Cheung, J., Zhu, J., Su, X., Taylor, M.J., Wallweber, H.A., Sasmal, D.K., Huang, J., Kim, J.M., Mellman, I., and Vale, R.D. (2017). T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition. Science 355, 1428–1433.
6. Foster, B.A., Gingrich, J.R., Kwon, E.D., Madias, C., and Greenberg, N.M. (1997). Characterization of prostatic epithelial cell lines derived from transgenic adenocarcinoma of the mouse prostate (TRAMP) model. Cancer Res. 57, 3325–3330.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468362&idx=2&sn=ef6cc6e4ccf2e00f99a7ce2c46189e65&chksm=84e2e73eb3956e287dc16b52e508c58f98dbc0f3c8d4d44aa2df401304dbb625170d57046f4e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
研究透视:菊粉凝胶-增强T细胞功能与抗PD-1协同抗肿瘤
PD-1新用途:纪如荣团队发现PD-1调节吗啡镇痛

NCB :肿瘤外泌体蛋白促进癌细胞脑转移
中国抗癌协会整合肿瘤学分会成立大会在西安召开



第22届全国肿瘤防治宣传周启动仪式在北京举行



哈佛大学医学院Kucherlapati教授访问中国抗癌协会


三阴性乳腺癌患者的肿瘤浸润淋巴细胞水平与PD-1单抗keytruda应答率
第二代PD-1药物!小分子药亚甲基蓝可抑制PD-1功能
第十四届海峡两岸肿瘤学术会议在台北成功召开



科学家发现菊粉凝胶可调节肠菌,增强T细胞功能并与抗PD-1协同抗肿瘤