科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-03
来源:BioArt
从组蛋白到非组蛋白乙酰化修饰的研究有超过50年的历史,研究已取得丰硕的成果,乙酰化调节的蛋白质功能和定位的改变被证实参与到机体的各项生理活动当中。尽管如此,仍有很多新的蛋白质乙酰化修饰被报道,主要原因是更加先进的质谱技术使得低丰度乙酰化蛋白被发现;其次,蛋白质乙酰化研究更加精密化,对于特定状态下的准确调控机制成为新的研究方向,而乙酰化修饰作为细胞应激的功能性调节机制仍然值得探索。
乙酰化修饰所需的底物是乙酰辅酶A。已报道细胞饥饿条件下乙酰辅酶A的含量会明显下调【1,2】,因此非酶催化的乙酰化作用呈现下降的趋势【3】,同时饥饿时NAD+上调促使Sirtuin家族蛋白的去乙酰化作用上升也使全蛋白乙酰化水平大幅度下降。在此条件下是否有一些蛋白仍然有逆势上升的乙酰化调节?这些乙酰化水平上调的蛋白是否能够在饥饿条件下对维持细胞的正常功能起到关键作用?
前体RNA选择性剪切作为细胞内蛋白质多样性的基础在机体的稳态和生命进程中都起到至关重要的作用。多项研究都证实异常剪切导致蛋白促癌功能的激活是癌症发生发展的重要因素【4】。目前尚没有研究证实哺乳动物剪接体机器蛋白的直接乙酰化修饰参与调控选择性剪切。
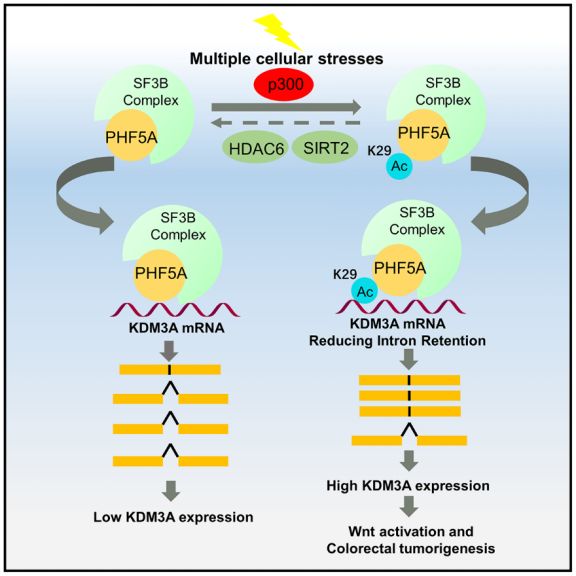
近日,来自北京大学基础医学院罗建沅课题组在Molecular Cell发表题为Acetylation of PHF5A modulates stress response and colorectal carcinogenesis through alternative splicing mediated upregulation of KDM3A的研究,报道了乙酰转移酶p300介导的剪接体蛋白PHF5A乙酰化修饰通过调节KDM3A的选择性剪切在细胞应激以及结肠癌发生中发挥了重要的作用。

研究人员通过TMT标记的定量乙酰化组学和乙酰化抗体免疫沉淀蛋白质组学的方法,分别检测了HCT116细胞在饥饿的条件下蛋白质乙酰化水平的变化,共鉴定出58个乙酰化修饰上调的蛋白(Acetylation upregulated protein, AUPs)。通过对AUPs进行聚类分析,研究人员发现一类显著聚集的蛋白:RNA结合蛋白,它们主要参与到RNA加工和RNA代谢的过程。在这些蛋白中PHF5A引起了研究人员的关注,其作为剪接体U2 snRNPs复合物的组分,主要在前体RNA剪切的过程中发挥了识别内含子3’端的分支点序列(Branch Point Sequence,BPS)的作用,从而保证RNA剪切过程的精准无误。
研究人员通过质谱分析鉴定出第29位的赖氨酸为其主要的乙酰化修饰位点。在应对多种应激条件下,PHF5A-K29的乙酰化水平均是明显上升的,证明PHF5A-K29的乙酰化修饰在细胞应对应激反应中的广泛性。为了进一步研究在应激条件下PHF5A-K29的乙酰化修饰上调的机制,研究人员通过体内和体外的乙酰化实验发现p300为其主要的乙酰基转移酶。在多种应激条件下,敲低p300后PHF5A-K29的乙酰化修饰均没有变化,证明p300可以感应细胞内的刺激,并且上调PHF5A-K29的乙酰化修饰水平。
已有的报道证实,PHF5A不仅在前体RNA剪切中发挥作用,同时也可以作为共激活因子促进基因的转录。那么,高乙酰化的PHF5A具体发挥什么功能呢?研究人员发现模拟高乙酰化状态的PHF5A K29Q能够促进结肠癌细胞的增殖。而K29Q突变体比起WT能够更加紧密地结合U2 snRNPs相关蛋白,因此PHF5A的乙酰化修饰很可能通过调节了整体的剪切水平促进结肠癌细胞的增殖。通过RNA高通量测序发现,PHF5A K29Q能够影响190个基因的表达水平和539个基因的剪切方式。由于剪切过程中的内含子通常能引起无义介导的mRNA降解【5】。因此,鉴定出11个剪切方式和表达水平均受到PHF5A K29Q的影响的基因。其中,去甲基化酶KDM3A引起了研究人员的注意,并通过荧光素酶和mRNA稳定性实验证明PHF5A K29Q通过下调其转录后异常剪切来上调KDM3A的表达水平。进一步实验发现PHF5A K29Q能够通过上调KDM3A激活Wnt信号通路下游靶基因的转录。
为了进一步验证以上的结果,研究人员收集了90对结肠癌患者的肿瘤组织和癌旁组织进行免疫组化染色,发现肿瘤组织中PHF5A-K29乙酰化水平明显高于癌旁组织,并且PHF5A-K29乙酰化水平和结肠癌AJCC临床分期具有明显的相关性,PHF5A呈高乙酰化状态组的患者三年生存率明显低于呈低乙酰化状态组患者。同样针对KDM3A的表达水平进行分析发现,KDM3A的表达水平和PHF5A-K29的乙酰化水平具有明显的相关性。
总的来说,研究发现了乙酰化和剪接体之间的一个新的联系,乙酰化修饰的PHF5A能够利用转录后调节来帮助癌细胞应对细胞应激并存活下来,进而促进肿瘤的发生。这项发现拓展了乙酰化的研究领域,将其与RNA相关功能联系起来。
据悉,罗建沅课题组的博士生王哲和杨鑫为共同第一作者,罗建沅教授为论文通讯作者。哥伦比亚大学顾伟教授,深圳大学朱卫国教授,北京大学张宏权教授、尹玉新教授和刘小云教授给予了大力支持。
罗建沅教授简介:

罗建沅教授,博士生导师,1986年本科毕业于北京大学生物系,1990年在该系获硕士学位并留校任教担任讲师。1992年赴美留学,在肯塔基大学获博士学位。哥伦比亚大学博士后。2003年起,在麻省大学医学院癌症生物学系担任助教授并建立实验室。2010年到2015年,马里兰大学医学院担任副教授。2015年全职回国。现担任北京大学基础医学院学术委员会主任,北京大学生物化学和生物物理学系主任,北京大学医学遗传系主任,北京大学医学遗传中心主任, 北京市蛋白质修饰与细胞功能重点实验室主任。主要从事蛋白质翻译后修饰在癌症发生、发展及细胞衰老中的功能调节等方面的研究。在蛋白乙酰化修饰调控蛋白功能方面作出了突破性的贡献。尤其是对癌症抑制因子p53的去乙酰化调控的研究为世界首创。论文曾发表在Nature, Cell, Molecular Cell,PNAS等杂志上。所发表的文章被引用近7千次。其中发表在Cell上的关于组蛋白去乙酰化酶SIRT1调控癌症抑制因子p53的研究开创了SIRT1的研究领域。在美国主持NIHR01等研究基金,回国后主持5项国家自然科学基金并参与一项973项目。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469454&idx=5&sn=f3d246871138e4019e1112443f8f41ff&chksm=84e2eb7ab395626c761aaa1167554c1fc1e54cd3c526a1821d8119f45d45fe093b76734542fe&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

研究揭示植物SUVH家族组蛋白甲基化酶的调控机理
蛋白质设施用户揭示组蛋白分子伴侣OsChz1调控染色质结构的分子机制
复旦大学揭示水稻组蛋白分子伴侣OsChz1调控染色质结构的分子机制

研究揭示组蛋白H2A泛素化修饰对核小体的调控机制
蛋白质设施用户揭示植物组蛋白分子伴侣识别组蛋白的结构基础
突破!南方医科大学夏来新/肖姗揭示RNA修饰调控组蛋白修饰过程
Nature子刊:揭示m⁶A通过共转录逆向调控组蛋白修饰的现象和机制

Nature背靠背:组蛋白H1调控染色质结构
Nat Comm: 组蛋白去乙酰化酶3调控卵母细胞成熟分子机制
科学家揭示组蛋白变体H2A.Z调控体内核小体的展开