科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-08
来源:BioArt
线粒体由于能够产生和储存代谢物而成为细胞内多种信号途径的联结点。线粒体的动态变化比如数量、生物合成、形态学、运动性等方面都与细胞功能的正常运转息息相关【1】。而且已有一些研究表明线粒体对于维持多能干细胞的多能性与起始分化等方面发挥着关键的作用【2】。尽管精原性干细胞在男性生育和生殖中发挥着重要作用,但是线粒体的动态变化在生殖干细胞(Germline stem cells, GSCs)中的作用还不甚清楚。
为了对该问题进行解析,2019年6月4日,来自加州大学洛杉矶分校的D. Leanne Jones研究组在Nature Cell Biology上发文Mitochondrial fusion regulates lipid homeostasis and stem cell maintenance in the Drosophila testis,揭开了线粒体融合通过调节脂质稳态而在果蝇生殖干细胞命运的维持中发挥关键作用。

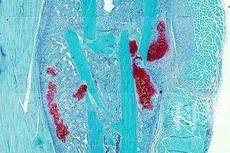
果蝇睾丸的顶端主要由GSCs(germline stem cells)以及包裹着GSCs的包囊干细胞组成,GSCs紧挨着中心细胞。GSCs分裂自我更新产生后代并分化产生成精原母细胞,成精原母细胞经过四轮不完全胞质分裂产生16个连通的精原细胞,随后分化形成精母细胞,精母细胞然后通过减数分裂产生精子(图1)。
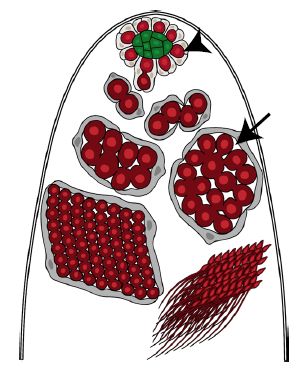
图1 果蝇睾丸示意图。三角箭头所指的浅红色细胞为生殖干细胞,长箭头指示的是精母细胞。
为了研究线粒体动态变化在生殖干细胞中的作用,Jones研究组在果蝇的雄性生殖细胞系中建立了不同的RNAi品系(图2)。通过筛选后作者们发现了两个与线粒体形态相关的两个重要基因Mfn(homologue of Mitofusin)与Opa1(Optic Atrophy 1),敲低后显著影响果蝇生殖干细胞的数量。Opa1是调节线粒体内膜外膜融合的GTPase。其中Mfn-Guo以及文中标记为Guo的果蝇均来自于加州大学Ming Guo教授实验室。
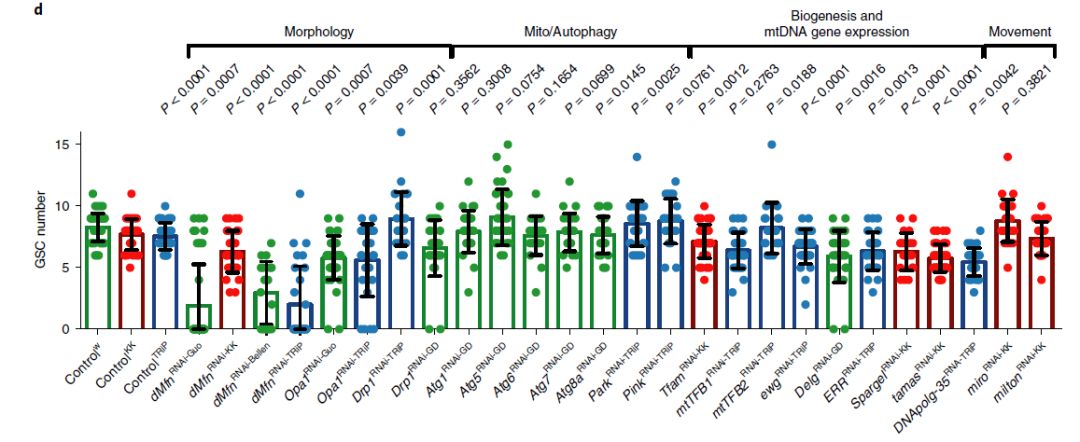
图2 RNAi筛选结果。发现Mfn与Opa1敲低后显著影响果蝇生殖干细胞的数量
在敲低Mfn与Opa1后,作者们发现早期的生殖细胞中会产生肿胀的线粒体,而且线粒体中嵴的结构也变得异常。正常的线粒体融合会引起线粒体DNA、蛋白质以及一些脂质的混合【3】,这对于维持线粒体的功能非常重要。而线粒体融合被破坏则会造成膜电势的消失以及mtDNA的丢失。而Mfn敲低后表现出线粒体膜电势消失,进一步说明Mfn对于生殖细胞数量的维持可能是与线粒体融合相关。
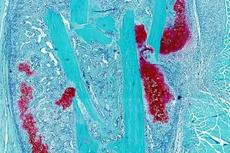
随后,作者们发现线粒体融合发生异常后,TOR被激活。TOR可以作为干细胞行为的调控因子【4】,组成型激酶激活形式的TOR在哺乳动物与果蝇中过表达都会造成干细胞缺失以及促进干细胞分化【5】。同时Mfn敲低引起的线粒体功能异常会造成脂滴的大量积累(图3)。
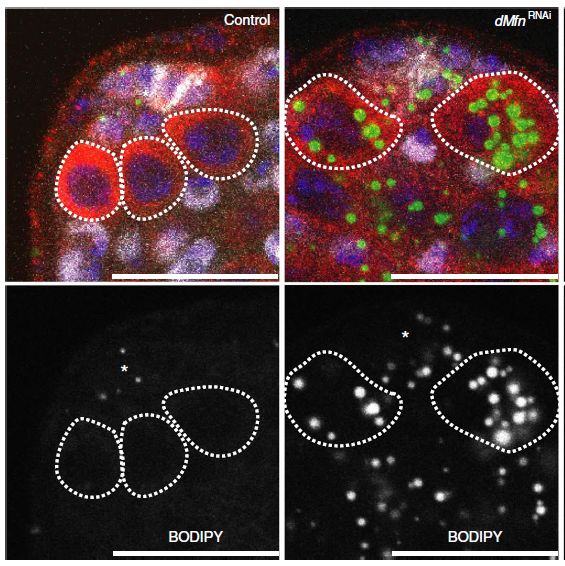
图3 脂滴在Mfn敲低的背景下异常累积
这些结果表明线粒体融合的正常进行对于维持雄性生殖干细胞具有非常重要的作用。具有活性的线粒体能够通过脂肪酸氧化过程调节脂肪酸的水平。在正常情况下,脂肪酸的水平会被维持的很低,生殖干细胞能够正常存在。而随着脂肪酸的水平增加,TOR会被激活从而刺激脂质合成,进一步引起脂滴累积,造成生殖干细胞的丢失。线粒体功能异常、TOR激活以及脂滴的累积与一系列的代谢疾病相关,比如胰岛素抵抗以及二型糖尿病。
因此,Jones研究组的工作对于脂肪酸代谢在生殖细胞的增殖与成熟过程中发挥的作用进行了解析,同时为雄性不育的治疗方面提供了新的治疗思路也为多种代谢方面的疾病给予了新的思考方向。
原文链接:
https://doi.org/10.1038/s41556-019-0332-3
制版人:珂
参考文献
1. Chandel, N. S., Jasper, H., Ho, T. T. & Passegue, E. Metabolic regulation of stem cell function in tissue homeostasis and organismal ageing. Nature cell biology 18, 823-832, doi:10.1038/ncb3385 (2016).
2. Zhang, H., Menzies, K. J. & Auwerx, J. The role of mitochondria in stem cell fate and aging. Development 145, doi:10.1242/dev.143420 (2018).
3. Schrepfer, E. & Scorrano, L. Mitofusins, from Mitochondria to Metabolism. Molecular cell 61, 683-694, doi:10.1016/j.molcel.2016.02.022 (2016).
4. Meng, D., Frank, A. R. & Jewell, J. L. mTOR signaling in stem and progenitor cells. Development 145, doi:10.1242/dev.152595 (2018).
5. LaFever, L., Feoktistov, A., Hsu, H. J. & Drummond-Barbosa, D. Specific roles of Target of rapamycin in the control of stem cells and their progeny in the Drosophila ovary. Development 137, 2117-2126, doi:10.1242/dev.050351 (2010).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652470988&idx=4&sn=a33a501a270cd3da23cda37028c13f63&chksm=84e2ed78b395646e45ed396b93c36e64462c984090e142a11da6777041636e4b22b8eeed40b5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

3D迷你大脑,助力脑功能修复研究
反式脂肪酸之惧
三甘油脂肪酸酯
谢琦博士等解析胶质瘤干细胞脂肪酸代谢的表观调控机制
Nature:脂肪酸控制骨骼肌干细胞再生
Nature揭示骨骼干细胞发育令人惊讶的影响因素:脂肪酸
衰老: 恢复雄性果蝇的性欲

果蝇怎么找到食物的?这可提升计算机相似性搜索

零反式脂肪酸食品并非不含反式脂肪酸!长期吃会损伤记忆力
中国首个干细胞通用标准发布,规范国内行业发展