科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-13
来源:X一MOL资讯
阿尔兹海默症(Alzheimer's disease,AD)俗称老年痴呆,是老年人群中最常见的慢性神经退行性疾病。其早期临床表现为记忆障碍,随着病情的发展,患者继而出现语言障碍、情绪紊乱、运动障碍、视空间技能损害甚至人格和行为改变等神经精神症状,严重影响社交、职业与生活,并使身体机能逐渐丧失,最终导致死亡。截止到2016年底,全世界大概有4700万人遭受着AD的困扰,其中我国的患者数量已经突破了1500万,绝对数量居于世界首位。同时这些患者中绝大多数是大于65岁的老年人,这就使得AD患者已经成为社会和家庭的严重负担。据世界卫生组织的统计数据表明,全球目前用于照顾AD患者的费用已经高于心血管病、癌症和脑中风这三种疾病的总和。因此,寻找这个疾病的治疗手段已经刻不容缓。
到目前为止,AD的确切发病机制还没有完全研究清楚,研究人员为此也提出了多种致病机理假说。其中β-淀粉样蛋白级联假说(amyloid cascade hypothesis)占据主流地位,因为AD的重要病理特征是患者脑内细胞外的老年斑沉积(senile plaques, SP),而SP中的主要成分是Aβ,因此多数学者认为Aβ的过量表达及其聚集沉积形成老年斑是AD病理的中心环节,可以引发其它一系列病理过程,而其他的病理过程反过来又会加速Aβ的沉积,造成了一种恶性的循环,加重了AD病情的发展。由此可知,抑制Aβ的聚集是预防和治疗AD的重要策略,具有很好的预防和治疗的前景。
Aβ的神经毒性与其聚集状态直接相关。一般认为,在正常生理状态下,Aβ单体是没有毒性的。然而,当Aβ单体形成具有β-折叠结构的聚集体时,其对神经元有明显的毒性作用,且不同形态和结构的聚集体的毒性是不同的。近期研究发现,Aβ寡聚体的毒性比成熟纤维的毒性要大,是最主要的毒性物种,能够快速引起神经元死亡。既然Aβ的神经毒性与其聚集状态直接相关,那么抑制Aβ的聚集就成为了治疗AD的重要手段,目前也受到最广泛的关注。
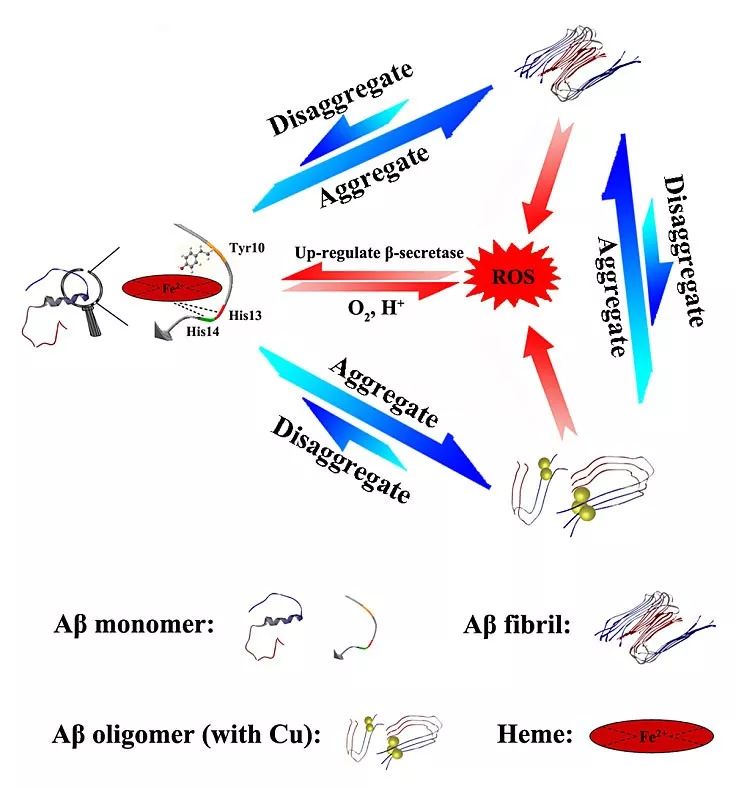
然而目前对于抑制剂的设计,大多没有考虑到手性的问题。手性在自然界中是广泛存在的,在生物体内具有明显的偏好性和严格的选择性。例如,在DNA的形成过程中只会利用D型的糖分子,而蛋白质基本上都是由L-氨基酸构成的,这些手性分子单元既可以决定生物分子的构象,也可以决定生物分子的生物学功能。而对于像淀粉样蛋白这样的大分子聚集体系而言,一般总是包含了四级手性结构。第一级手性结构是由立体中心(也称为“手性中心”)构成的,最常见的例子就是我们所熟知的手性碳结构,因此第一级手性结构也称为“构型手性”;第二级手性结构是由分子构象的不同影响产生的,也称为“构象手性”;第三级手性结构与单晶或螺旋单体的相结构有关,因此也称为“相手性”;最后,螺旋的单结构域的聚集构造成了宏观的手性物体,这就是第四级手性结构,也称为“物体手性”。
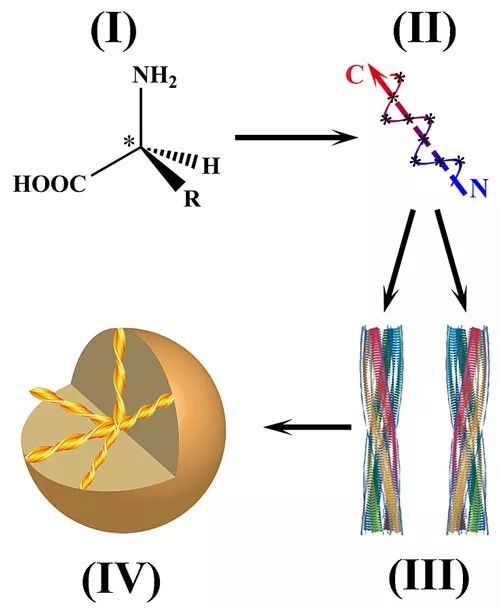
更重要的是,AD的致病蛋白Aβ纤维也包含了上述所有等级的手性结构(在“相手性”结构层面上,Aβ纤维会特异性地形成左手旋螺结构),因此,在设计Aβ靶向抑制剂时,手性一直是选择性的关键问题之一。一方面,手性可以提高抑制剂对手性生物目标的对映选择性和特异性。另一方面,从药物设计的角度上看,手性也是近年来越来越受到关注的问题,因为许多药物分子都是手性的,在大多数情况下,只有一种对映体具有药物活性,而另一种对映体则是非活性、甚至会产生严重的生物副作用。因此,手性识别对抑制Aβ聚集起着至关重要的作用。
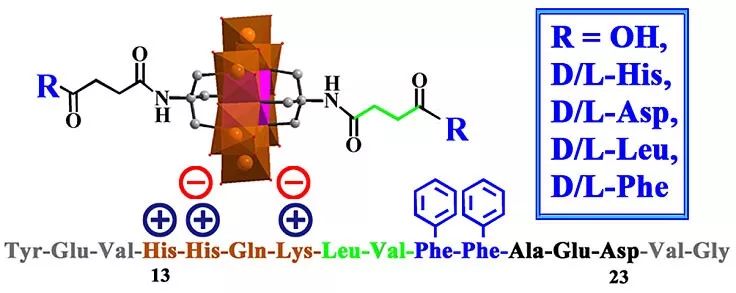
以多聚金属氧酸盐(POM)为例,说明如何用手性选择化学的方法来调节Aβ聚集。之前的报道显示了POM具有多种生物活性,包括抗菌、抗病毒和抗癌活性,因此其作为生物医学药物显示出巨大的潜力。然而,POM与生物分子的相互作用主要依赖于良好的静电吸引和尺寸效应,这些效应很强,但不具有特异性,也没有特定的手性识别。因此,基于近年来发展的POM表面修饰技术,可以实现降低POM的毒副作用、增强特异性识别的效果。
中国科学院长春应用化学研究所曲晓刚课题组之前的工作显示,POMS可以通过结合Aβ上的阳离子簇(13位的组氨酸到16位的赖氨酸,HHQK)来抑制Aβ的聚集,同时这个阳离子簇也位于Aβ的13-23区域(HHQKLVFFAED)组成的α/β不一致区域中。该区域在正常情况下形成α-螺旋的结构,在Aβ聚集过程中该区域被预测形成β-片层结构,从而加速了Aβ的聚集。由于α-螺旋和β片层结构的都具备了复合手性结构,因此Aβ也对手性环境很敏感,Aβ链的定向和手性环境将强烈影响影响Aβ的聚集过程。最近,该课题组在Aβ13-23区域氨基酸序列的基础上,对POM进行了合理的设计和合成,得到了手性POM衍生物,这些POM能够特异性的结合到Aβ13−23段,并且在抑制Aβ聚集方面具有很强的手性选择性。该设计基于以下原因:(1)POMS与阳离子团簇HHQK结合;(2)之前的报道显示Aβ上的Leu 17和Val 18(L17V18)序列能够与烃链相互作用;(3)Aβ上接下来的序列由两个相邻的苯丙氨酸残基(F19F20)组成,形成了一个强疏水区,能够通过疏水作用与其他疏水氨基酸发生特异性的相互作用。因此,F19F20位点可用于POM的设计和改进。然而,目前尚不清楚哪种氨基酸能显示出最好的效果。此外,基于Aβ的手性敏感性,POM上修饰的氨基酸的手性选择也是至关重要的。因此,他们合成了一系列手性氨基酸功能化的POM衍生物,包括带正电的氨基酸(D-His和L-His)、带负电的氨基酸(D-Glu和L-Glu)和疏水性氨基酸(D-Leu、L-Leu、D-Phe和L-Phe),随后对所有手性POM衍生物与Aβ的结合亲和力和对映选择性进行筛选。
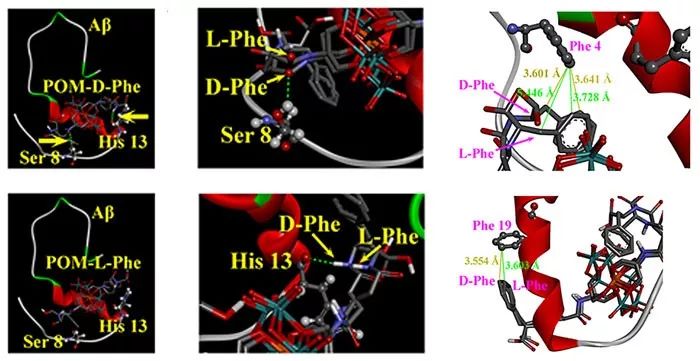
筛选结果显示,所有的手性POM衍生物都可以结合在Aβ的13-20位区域(HHQKLVFF),且在修饰的四种氨基酸中,修饰了苯丙氨酸的衍生物POM-Phe与Aβ之间的相互作用是最强的,同时修饰了D-型苯丙氨酸的衍生物POM-D-Phe与Aβ之间的结合力又比修饰了L-型苯丙氨酸的衍生物POM-L-Phe强7.8倍,证实了作者之前的设计是正确的。为了更好地理解这两种手性抑制剂与Aβ1-40单体的相互作用差异,作者进行了分子动力学模拟。模拟的结果显示了两个结果,首先,与POM-L-Phe相比,POM-D-Phe与Aβ之间形成了两个额外的氢键,分别位于Ser 8和His 13处。对于Ser 8,POM-D-Phe中的烃链要更加接近Ser 8的羟基,从而形成氢键;相反,由于POM-L-Phe中的烃链远离Ser 8的羟基,因此不能形成氢键(图1c)。在His 13位点也可以观察到类似的情况。此外,POM-D-Phe中的苯丙氨酸残基也更接近Aβ1-40中的两个疏水氨基酸残基(Phe 4和Phe 19),这进一步增强了它们之间的疏水相互作用和π-π堆积作用。因此,基于上述实验数据和模拟结果,可以更好地理解POM-L-Phe和POM-D-Phe的结合机理和产生手性差异的原理。
在Aβ的各个聚集形态中,寡聚体、原纤维和纤维都存在着β-片层结构,这种结构导致了Aβ的聚集及其神经毒性。由于POM-L-Phe和POM-D-Phe与Aβ之间存在着强烈的结合能力,因此它们可以稳定Aβ单体,防止向β-片层结构转变,从而实现高效抑制Aβ聚集的效果。为了验证上述设想,作者开展了CD、ThT、IC50等实验,实验结果也证实了POM-L-Phe和POM-D-Phe可以高效抑制Aβ中β-片层结构的形成,从而抑制了Aβ的聚集,并降低了Aβ产生的细胞毒性。目前,开发AD治疗药物的一个主要障碍是大多数小分子或肽很难穿过血脑屏障(BBB)。因此,作者利用活体实验同样证明了POM-D-Phe是可以透过BBB,并且在随后的时间里是会被完全代谢出体外的。体内也研究表明,POM-L-Phe和POM-D-Phe能够显著延长了常用的AD转基因秀丽隐杆线虫CL2006的寿命。
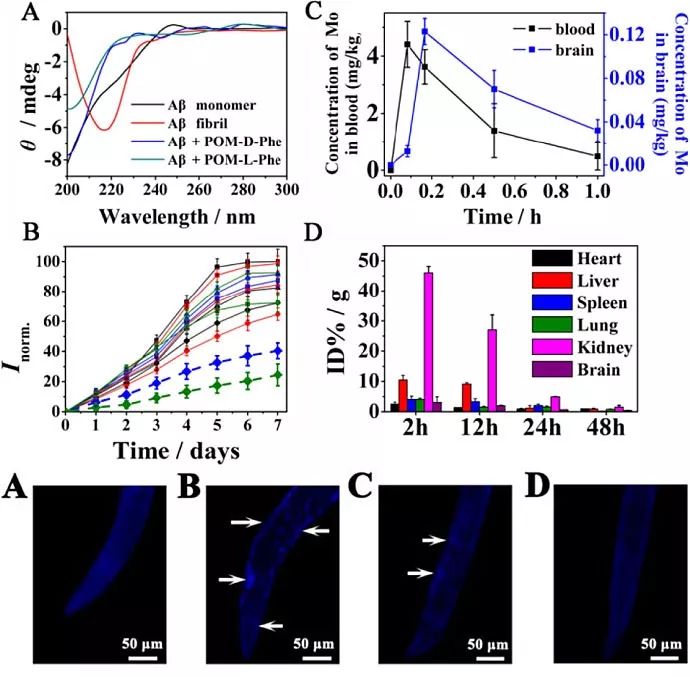
上述工作为发展AD治疗试剂、手性调控生物分子功能提供了新的思路。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657615466&idx=8&sn=a3b59f8789e202429254dc65176fa228&chksm=80f7d7bab7805eacb11286079becd89e01ad405add57a2d4f6cb1672c910f0162e393a388e3f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
肠上皮产生特殊氨基酸调控睡眠

废弃塑料升级转化制氨基酸
世界辣么大!这个小伙儿竟然只吃马铃薯
Nature | 为生物大分子的特异性标记提供理论基础——含炔烃氨基酸的生物合成
必需氨基酸检查

比生物界“AlphaGo”更厉害的模型来了?
胰腺特异性抗原(PaA)
酸性氨基酸
前列腺特异性抗原检查
氨基酸清除率测定